
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Как составляются уравнения реакций?
|
|
|
|
Для лучшего понимания сущности и подбора коэффициентов в данных уравнениях используют электронные и ионно – электронные уравнения.
Метод подбора коэффициентов при помощи электронных уравнений называют методом электронного баланса. Для подбора коэффициентов в уравнениях реакций протекающих в водных растворах, используют ионно-электронные уравнения, т.к. при реакциях окисления-восстановления электроны только переходят от одних атомов или ионов к другим, то очевидно, что число электронов, приобретаемое окислителем, должно равняться числу электронов, отданных восстановителем.
Как составлять уравнения реакций с помощью метода электронного баланса:
1. написать уравнение реакции;
2. определить степень окисления элементов до и после реакции и отметить ее цифрами;
3. записать происходящее при реакции перемещение электронов в виде электронных уравнений;
4. в правой части записываем, какой процесс происходит при этом перемещении электронов и выносим количество электронов, которые перемещаются;
5. в левой части уравнения записываем, чем является элемент в процессе перемещения электронов;
6. слева от уравнения ставим коэффициенты, которые должны уравнять число отданных восстановителем и принятых окислителем электронов, т.е. мы находим коэффициенты при окислителе и восстановителе;
7. уравниваем оставшиеся ионы веществ.
Например:
4 Al + 3 O2 = 2 Al2O3




 восстанов. 4
восстанов. 4 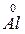 – 3
– 3  =
=  3 процесс окисления
3 процесс окисления
окислит. 3 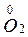 + 4
+ 4  =
=  4 процесс восстановления
4 процесс восстановления
8 HJ + H2SO4 = 4 J2 + H2S + 4 H2O
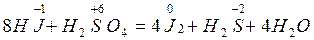



 восстанов. 8
восстанов. 8 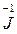 – 1
– 1  =
=  1 процесс окисления
1 процесс окисления
окислит. 1  + 8
+ 8  =
=  8 процесс восстановления
8 процесс восстановления
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 451; Нарушение авторских прав?; Мы поможем в написании вашей работы!