
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 5. Система комплексного экономического анализа и поиска резервов
|
|
|
|
А В
В А
Соединение атомов происходит в результате образования химических связей между ними. Химические связи – это результат изменения состояния внешних электронов атомов, сопровождающегося понижением их энергии. Поэтому при классификации химических реакций учитывается изменение состояния электронов и характера химических связей. Все реакции оказалось возможным разделить на два типа – окислительно-восстановительные и кислотно-основные. Об окислительно-восстановительных реакциях вы имеете достаточное представление. Они характеризуются переносом разного числа электронов от одних атомов к другим и вытекающим отсюда изменением степеней окисления.
Класс явлений, изучением которых занимается химия, сводится к соединению атомов между собой, разъединению атомов и перегруппировкам атомов. Это выглядит довольно просто. Но подробное изучение этих процессов приводит к накоплению огромного фактического материала, созданию многих теорий, и все это составляет то, что называется наукой химией. С соединением атомов приходится сталкиваться сравнительно редко, главным образом в лабораторных экспериментах, потому что все они уже соединены между собой (в условиях нашего обитания). Разъединение атомов происходит, главным образом, при очень сильном повышении температуры. Таким образом, самой широко распространенной группой явлений оказываются перегруппировки атомов – то, что мы встречаем в большинстве химических реакций.
Но о реакциях второго типа обобщенного представления у вас нет. Часто вспоминают, что есть реакции замещения, обмена, соединения и разложения. Но это классификация по другому признаку – не по электронным процессам, а по числу исходных веществ и продуктов реакции. На самом деле все реакции, не являющиеся окислительно-восстановительными, можно объединить по общему признаку передачи электронных пар от одних атомов к другим, и назвать кислотно-основными. О них мы и будем говорить на трех очередных лекциях. Можно сказать, что все вещества проявляют кислотные и основные свойства, а часто и то, и другое сразу.
|
|
|
В чем причина того, что обширный тип реакций назван именно кислотно-основными реакциями? Кислоты представляют собой самый древний класс веществ, хотя в древности они не назывались классом. Просто они выдавали себя кислым вкусом. Способность воспринимать этот вкус является прямым указанием на особое значение кислот для живых организмов.
В развитии химии важным этапом было получение концентрированных растворов сильных кислот. С их помощью можно было растворять металлы, различные минералы, полностью переводить в раствор вещества растительных и животных клеток. Тогда же были открыты вещества, нейтрализующие кислоты, устраняющие их химическое действие и кислый вкус. Они были названы щелочами. Постепенное развитие химии вызывало возникновение все более широких обобщений относительно природы кислотно-основного взаимодействия, что и привело в итоге к разделению всех химических процессов на окислительно-восстановительные и кислотно-основные.
Проблема кислот и оснований оказалась настолько сложной, что привела к возникновению целого ряда теорий, некоторые из которых сохраняют свое значение и в настоящее время. Из старых теорий можно упомянуть кислородную теорию, выдвинутую в 1777 г. великим французским химиком А. Лавуазье. Он считал, что наиболее чистый удобовдыхаемый воздух представляет собой непременное кислотообразующее начало. По Лавуазье, этот газ («начало») входит в состав всех кислот, что и отражено в названии, предложенном Лавуазье для него – в переводе на русский язык это кислород (oxygenium). Здесь Лавуазье проявил излишнюю категоричность. Он утверждал, что кислород есть и в составе таких кислот, как хлороводород, которые позднее стали называться бескислородными. Делались попытки разложить хлороводород на кислород и особый элемент мурий. С современных позиций рациональное зерно кислородной теории Лавуазье можно видеть в том, что большинство кислот это так называемые ОН-кислоты, в которых замещающийся водород связан с атомом кислорода.
|
|
|
Спустя 110 лет новую и очень успешную теорию кислот и оснований выдвинул шведский химик С. Аррениус. Он объяснил природу кислот и оснований на основе своей теории электролитической диссоциации. Кислота является источником ионов водорода, Н+, а основание – источником ионов гидроксида, ОН– . Эти ионы при реакции кислоты с основанием образуют молекулы воды. Теория Аррениуса все же имеет существенные недостатки. В качестве оснований в ней рассматриваются только гидроксиды. Кислотами по этой теории не могут быть неэлектролиты. Вещества жестко делятся на классы кислот, оснований, оксидов, солей, но свойства кислотности и основности могут проявляться в разных классах веществ. Рассмотрение кислотно-основных взаимодействий ограничивается только водными растворами. И, наконец, в теории Аррениуса не могла быть учтена особая роль иона водорода (протоны и электроны еще не были известны) как частицы, по своим характеристикам отличающейся от всех других ионов. На теории Аррениуса не могло закончиться познание сущности кислотно-основных свойств веществ.
В 20-х годах XX века в результате открытия субатомных частиц (пока только электронов и протонов) и утверждения в химии теории строения атома, появляются новые теории кислот и оснований, делающие понятной сущность кислотно-основ-ных взаимодействий в различных условиях. Эти теории не противоречат одна другой, а дополняют друг друга.
Одна из теорий, появившихся в этот период, получила название теории сольво-систем. Она применима к кислотно-основным взаимодействиям в любых растворителях и позволяет рассматривать в качестве кислот и оснований вещества разных классов. Кэди и Илси (1928) предложили следующие определения кислот и оснований. Кислота – вещество, повышающее при растворении концентрацию катионов данного растворителя. Основание – вещество, повышающее концентрацию анионов растворителя. Теория охватывает любые механизмы, приводящие к изменению концентрации ионов. Если взять в качестве растворителя воду, то такие вещества, как гидроксид калия и аммиак окажутся основаниями. Но они проявят свои свойства по разным механизмам. Гидроксид калия непосредственно образует анионы растворителя OH– при растворении:
|
|
|
KOH = K+ + OH–
Аммиак будет обратимо реагировать с водой, так же повышая концентрацию анионов растворителя:
 NH3 + H2O NH4+ + OH–
NH3 + H2O NH4+ + OH–
В качестве примера кислоты возьмем оксид серы(VI). Известно, что при растворении в воде получается раствор с кислотными свойствами, то есть повышается концентрация катионов растворителя Н+. Кислая среда возникает вследствие образования серной кислоты по реакции
SO3 + H2O = H2SO4,
но в данном контексте важно, что непосредственно оксид серы(VI) проявляет себя как кислота.
Существенную роль в химии играет электронная теория кислот и оснований, предложенная американским химиком Гилбертом Льюисом (1926). Она с единых позиций охватывает все химические реакции, не сопровождающиеся изменением степеней окисления атомов. Обычные кислоты и основания, рассматривающиеся в теории Аррениуса, в электронной теории становятся одной из разновидностей в обширной совокупности кислот и оснований.
Кислотой в теории Льюиса считается частица, содержащая атом – акцептор электронной пары. Такая частица называется также электрофилом. Основание – частица, содержащая атом донор электронной пары. Другое название такой частицы – нуклеофил. Таким образом, в основе кислотно-основного взаимодействия оказывается способность образовывать химические связи по донорно-акцепторному механизму.
В общем виде кислоту обозначают как частицу со свободной орбиталью
 А или просто А
А или просто А
Основание обозначают как частицу с неподеленной электронной парой
|
|
|
В: или просто В
Свободные орбитали и неподеленные пары не обязательно имеются в основном состоянии реагентов, но могут возникать в ходе химического взаимодействия. В непредельных соединениях роль свободной электронной пары может выполнять электронная пара π-связи.
Кислотно-основные реакции могут иметь характер соединения, обмена, замещения. Представления электронной теории применимы как к неорганическим, так и к органическим веществам и реакциям. Рассмотрим пример – присоединение хлороводорода к этилену. Сначала ион водорода Н+ атакует атом углерода, притягивая наиболее подвижную пару электронов π-связи. Смещение π-электронов обозначают дугообразной стрелкой:

+


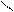 Н Н Н
Н Н Н

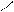
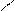
 С = С + Н+ ® С – СН3
С = С + Н+ ® С – СН3
Н Н Н
На этой стадии реакции молекула этилена играет роль основания, а ион водорода – кислоты. В образовавшейся частице (карбокатионе) атом углерода имеет свободную орбиталь и становится кислотой.
На второй стадии реакции к атому углерода в карбокатионе присоединяется анион хлора, имеющий 4 неподеленные электронные пары. Карбокатион играет роль кислоты, а ион хлора – основания. Для изображения схемы взаимодействия достаточно обозначить одну электронную пару хлора:
|
 Н
Н

 С – СН3 +:Cl– ® СН2Cl – СН3
С – СН3 +:Cl– ® СН2Cl – СН3
 Н
Н
Из показанного схематически процесса присоединения хлороводорода к этилену видно, что на первой стадии органическая молекула реагирует как основание, а на второй стадии образовавшийся карбокатион – как кислота.
Вообще, теория механизмов органических реакций базируется на электронной теории кислот и оснований.
Электронная теория Льюиса широко применяется в химии комплексных соединений, так как связи между центральным атомом и лигандами образуются по донорно-акепторному мехенизму. Центральный атом со свободными орбиталями это кислота, лиганды с неподеленными электронными парами – основания. Здесь, однако, обнаруживается слабая сторона теории Льюиса. Это невозможность построения единой шкалы для силы льюисовских кислот и оснований. Это можно показать на примере устойчивости комплексных соединений. Комплекс бериллия с ионами фтора [BeF4]2– более устойчив, чем комплекс меди [CuF4]2–. Это можно считать признаком более сильных кислотных свойств иона Be2+ по сравнению с ионом Cu2+. Но если сравнить устойчивость аммиачных комплексов, то оказывается, что [Cu(NH3)4]2+ более устойчив, чем [Be(NH3)4]2+. Очевидно, что сила кислот изменяется в различной последовательности по отношению к разным основаниям. Иначе можно сказать, что наблюдается избирательность взаимодействия кислот с разными основаниями.
Следует отметить, что представления о кислотах и основаниях в теории сольвосистем согласуются с представлениями электронной теории. Выше рассмотрен пример оксида SO3, показывающий, что он ведет себя как кислота. Выясним, является ли он кислотой согласно теории Льюиса. Представим схематически механизм реакции с водой:
 |

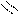

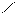 O H O O–
O H O O–

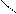

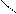 O = S: O → S + H+
O = S: O → S + H+
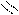 O H O OH
O H O OH
Атом серы в оксиде проявляет себя как кислота, будучи акцептором электронной пары кислорода, находящегося в молекуле воды. При этом электроны π-связи смещаются от серы к кислороду. Один из протонов воды остается в виде иона.
На электронной теории кислот и оснований основана концепция жестких и мягких кислот и оснований (ЖМКО), предложенная в 60-х годах прошлого века Р. Пирсоном. Концепция ЖМКО позволяет прогнозировать избирательное взаимодействие льюисовских кислот и оснований.
Жесткие кислоты и основания – это частицы, точнее соответствующий центр (атом) в частицах – имеющие малый радиус, трудно поляризующиеся.
Мягкие кислоты и основания – это частицы, имеющие кислотный или основной центр (атом) большого радиуса, легко поляризующийся.
| жесткие | мягкие | |
| Кислоты А | H+ (предельно жесткая), Na+, Ca2+, Mg2+, Al3+, H2O, Fe3+, | Ag+, Cu+, Tl+, Cd2+, Hg2+ |
| Основания В | F–, OH–, O2–, H2O, Cl– | I–, S2–, R–S–, As3– |
В группах сверху вниз наблюдается переход от жестких к мягким частицам (галогены).
Так в чем же значение этой классификации кислот и оснований?
Жесткие кислоты преимущественно образуют связи с жесткими основаниями, а мягкие кислоты – с мягкими основаниями.
В этом состоит предсказательное значение концепции ЖМКО.
Мягкие частицы образуют между собой преимущественно ковалентные связи, а жесткие – ионные.
Самопроизвольные кислотно-основные реакции идут не только в направлении от сильных к слабым, но и от частиц, сочетающих жесткий центр с мягким, к частицам, сочетающим мягкий центр с мягким и жесткий центр с жестким.
В организме человека жесткие кислоты Na+, K+, Mg2+, Ca2+,H+. Жесткие основания ОН –, F –
Мягкие кислоты – ионы d -элементов (медь, железо и др.). Железо(II) мягче железа(III). Мягкие основания – HS–, RS–, RSR. Токсичность ионов тяжелых металлов (таллий, ртуть, свинец) обусловлена их способностью образовывать связи с серой белков. Это ведет к блокированию ферментативной активности.
Явление симбиоза. Мягкий лиганд смягчает жесткую частицу:
KA–Zn2+ – связи с ионами галогенов ослабевают в ряду I – > Br – > Cl – > F – (КА – карбоангидраза)
H2O–Zn2+ – связи с ионами галогенов ослабевают в ряду F – > Cl – > Br – > I –
Важна не только характеристика частицы как таковой, но и ее положение относительно воды как растворителя, в котором обычно и осуществляются интересующие нас превращения. Например, среди галогенов фтор отделен от хлора в ряду понижения жесткости располагающейся между ними водой (также и ОН–):
F– > H2O (OH–) > Cl– > Br– > I–
Отсюда возникают любопытные закономерности в растворимости:
Ag+ < H2O < Li+ Li+×nH2O + F– = LiF¯ + nH2O
I– < H2O < F– Ag+×nH2O + I– = AgI¯ + nH2O
AgF + LiI = AgI¯ + LiF¯
Растворимость AgF >> AgCl > AgBr > AgI
170 г 0,002 г
Растворимость LiF << LiCl < LiBr < LiI
0,26 г 78,5 177 165
Дополнительное.
Радиус атома Н 50 пм (10–10 м). Радиус иона Н+» 0,01 пм (10–14 м).
Радиус атома Li 155 пм (10–10 м). Радиус иона Li+ 68 пм.
| Жесткие кислоты | Мягкие кислоты | ||
| +3 +4 | Сr, Co, Fe, As, CH3SH Si, Ti, Zr, U, Sn | +1 +2 | Cu, Au, Tl, Hg2+ Pd, Cd, Pt, Hg, CH3Hg+, Co(CN)52–, Pt4+, Tl3+ |
| Жесткие основания | Мягкие основания | ||
| H2O, OH–, F–, NO3–, CH3COO–, PO43–, SO42–, Cl–, CO32–, NH3, RNH2 | R2S, RSH, RS–, I–, SCN–, S2O32–, R3P, CN–, R-NC, CO, C2H4, H–, R– |
Промежуточные основания: C2H5NH2, C5H5N, NO2–, SO32–, O2, Br–.
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 191; Нарушение авторских прав?; Мы поможем в написании вашей работы!