
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція №3. Рідкий стан речовини
|
|
|
|
Основні питання:
1. Рідкий стан речовини. Властивості рідин. Характеристики рідкого стану речовини.
2. Поверхневий натяг рідин. Роль ПАР в технології приготування їжі: емульгування та піноутворення.
3. В’язкість рідин. Вплив в’язкості на якість і смакові властивості харчових продуктів.
З молекулярно-кінетичного погляду твердий, рідкий та газоподібний стани відрізняються інтенсивностями взаємодії молекул та їхнього теплового руху. Рідини (за структурою) займають проміжне положення між твердими речовинами та газами.
Характер теплового руху молекул рідини – локальні нерегулярні коливання навколо деяких положень рівноваги та неперервні стрибкоподібні переміщення з одного положення рівноваги в сусіднє, тобто трансляційні рухи, які передбачають існування в рідині вакантних місць. Призводять до високої дифузійної здатності рідини, обумовлюють текучість.
Головні особливості рідин:
ü структура – наявність „ближнього порядку” і відсутність „дальнього порядку” (обумовлена взаємодією молекул);
Невеликі агрегати, безладно орієнтовані, зв’язки в них постійно руйнуються й знову виникають. Ступінь упорядкованості частинок у різних рідинах різний і змінюється зі зміною температури.
ü ізотропність (фізичні властивості однакові в різних напрямках);
ü існують у певному інтервалі температур (температура плавлення – критична температура);
ü здатність зберігати свій об’єм, який під дією сил тяжіння набирає форму посудини;
ü існування в рідині вільної поверхні;
ü мала стисливість (подібно твердим речовинам), тобто наявність певного власного об’єму (невеликі відстані між молекулами).
Відомо багато речовин, перехід яких із кристалічного в ізотропний рідкий стан відбувається через проміжний – мезоморфний стан (рідкі кристали). Область його існування обмежена двома температурами – плавлення і просвітлення, ‑ при якій мутні утворення стають прозорими: Твердий кристал ó Рідкий кристал ó Ізотропна рідина
|
|
|
Температура плавлення Температура просвітлення
Рідкі кристали мають властивості: текучість (як рідини) та анізотропність (тверді кристали). Взаємна орієнтація молекул рідких кристалів є причиною існування дальнього порядку в одному або двох напрямах. У мезоморфному рідкокристалічному стані речовина може набувати форми краплі або форми посудини, в якій вона міститься. Рідкі кристали відкрили Рейнітцер і Леман (1888р.) в результаті спостережень за процесами плавлення.
Властивості рідин залежать:
S від об’єму молекул форми та полярності молекул;
Рідини, утворені полярними молекулами, орієнтуються різнойменними кінцями диполів одна до одної, при цьому виникають сили електростатичного притягання, відбувається асоціація молекул в складний комплекс.
Причина асоціації – наявність водневого зв’язку.
Водневий зв’язок іноді визначає структуру речовини й суттєво впливає на її фізичні та хімічні властивості. Завдяки Н-зв’язку молекули об’єднуються в асоціати, які можуть бути одновимірними ланцюгами та кільцями, двовимірними плоскими сітками й тривимірними просторовими структурами.
Наприклад, в усіх агрегатних станах молекули фтороводню асоційовані у зигзагоподібні й циклічні полімери з чотирьох-шести молекул. Асоціація спричиняє аномально високі температури плавлення та кипіння фтороводню порівняно з іншими галогеноводнями. Те, що фторидна кислота – слабка кислота – результат асоціації молекул НF у водному розчині.
S від асоціації;
Асоційовані рідини мають:
▪ більш високу діалектричну проникність;
|
|
|
▪ меншу леткість;
▪ більшу теплоту випаровування;
▪ високу температуру кипіння.
Відома аномалія густини води зумовлена тим, що в кристалах льоду кожна молекула води зв’язана з чотирма сусідніми Н-зв’язками – двома донорними через дві неподілені пари атома Оксигену й двома акцепторними через два атоми Гідрогену. Усі чотири зв’язки утворюють тетраедр, центр і вершини якого займають атоми Оксигену. Між атомами Оксигену розміщені атоми Гідрогену, два з яких сполучені з атомами Оксигену полярними ковалентними зв’язками, а два інших – водневими. Завдяки цьому утворюється нещільна гексагональна гратка з великим об’ємом порожнин. Під час танення льоду Н-звя’зки частково руйнуються, від стань між молекулами зменшується, тому густина води зростає. Нагрівання води приводить до збільшення її об’єму та до подальшого руйнування Н-зв’язків і тим самим зменшення об’єму. Внаслідок цього густина води при температурі 40С досягає максимуму. Якби вода не була асоційованою, то вона б переходила з твердого стану в рідкий при температурі – 1000С, а кипіла б при температурі – 80)С.
Здатність до асоціації виявляють амоніак, спирти, Гідроген пероксид, сірчана кислота та багато інших речовин.. Внаслідок асоціації амоніак легко зріджується і має високу температуру кипіння. Змішування двох асоційованих рідин – спирту і води – супроводжується виділенням теплоти й зменшенням об’єму, що свідчить про утворення сольватів і ущільнення структури при зв’язуванні водневими зв’язками різнорідних молекул.








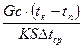 ,
,
де G – кількість рідини, кг;
С – питома теплоємкість рідини, Дж/(кг · К);
tк. та tп – температура кипіння і початкова температура рідини, С;
S – робоча поверхня апарату для варіння, м2;
Скорочення процесу варіння можна досягти за рахунок збільшення коефіцієнту теплопередачі К та середньої різниці температур Δtср. Максимально можливу різницю температур доцільно підтримувати на першому етапі варіння.
Нагрівання продукту до потрібної температури (другий етап) залежить від ряду факторів:
þ вільна конвекція при передачі теплоти від рідини до продукту;
|
|
|
þ властивості теплоносія та умови його підведення;
þ властивості самого продукту – теплоємкість, теплопровідність, структура, розмір, форма.
þ питома поверхня продукту (питома поверхня тим більше, чим ближча його форма до форми пластини. Найменшу питому поверхню, тобто найгірші умови для нагрівання продукту створюються якщо шматки продукту мають форму куба).
Умови збереження втрат поживних речовин в процесі варіння:
Ä забезпечення швидкого прогрівання рідини до моменту закипання;
Ä варіння продукту при спокійному (помірному) кипінні без википання рідини (виключення варіння у вакуумі);
Ä тривалість варіння не повинна перевищувати час, що необхідний для доведення продукту до кулінарної готовності.
Особливість варіння:
S практично не відбувається кипіння води в продукті (виключення процес варіння в атмосфері перегрітої пари);
S при варінні весь продукт занурений у рідину або знаходиться в атмосфері пари, що мають практично однакову температуру в усіх шарах.
S тепловий потік направлений від периферії до центру продукту;
S при варінні перенесення теплоти від теплоносія до продукту відбувається завдяки конвекції та теплопровідності.
8 Сутність процесу смаження.
Смаження – процес приготування продукту, коли кулінарна готовність продукту характеризується наявністю специфічної скоринки.
За теплообмінними процесами смаження буває двох видів:
1. Смаження відбувається на відкритій нагрівальній поверхні шляхом контакту продукту з цією поверхнею (з використанням жиру як проміжного середовища або без нього).
2. Смаження відбувається за відсутності безпосереднього контакту продукту з нагрівальним середовищем. Смаження відбувається при контакті з теплоносієм (гріюче середовище). Теплоносієм виступають розплавлений жир (фритюр) або повітря (випікання).
Особливість смаження:
S відбувається кипіння води в продукті завдяки значної різниці температур між теплоносієм і температурою кипіння;
S нагрівання відбувається або з однієї сторони продукту (смаження шляхом контакту продукту з нагрівальною поверхнею), або з усіх сторін, але в середовищі, що має різну температуру в різних шарах (смаження во фритюрі та в жарочних шафах);
|
|
|
S тепловий потік спрямований від периферії до центру.
Рівняння теплового балансу для всіх випадків смаження має вигляд:
G c (tк. – tп.) + D H = K S Δtср τ,
де G – маса продукту, кг;
С – питома теплоємкість продукту, Дж/(кг · К);
tк. та tп – кінцева та початкова температури продукту, С;
D – кількість вологи, що випарилася, кг;
Н – ентальпії пари, утвореної під час смаження, Дж/кг;
К – коефіцієнт теплопередачі від граючої поверхні або гріючого середовища до продукту, Вт/(м2 · К);
S ‑ поверхня нагріву, м2;
Δtср – середня температура між граючим середовищем і продуктом, С;
τ – тривалість процесу, с.
8 Процеси охолодження, заморожування і розморожування.
У процесах охолодження і заморожування використовують холодоносії – рідкі або газоподібні середовища з низькою температурою. Теплота від продукту переходить до холодоносія. При охолодження продукції до 0 С не змінюється її агрегатний стан. При температурі нижче 0 С відбувається заморожування вологи (теплообмінний процес із зміною агрегатного стану) продукту.
Теплообмінні процеси при заморожуванні відбуваються у два етапи:
1. Продукт охолоджується до кріоскопічної температури.
2. Перетворення вологи на лід.
Для складання теплового (енергетичного) балансу при охолодженні і заморожуванні продуктів нехтують тепловими втратами і втратами продукту (вони незначні).
Тепловий баланс при охолодженні продукту при використанні льоду має вигляд:
Gп сп (tп.п. – tк.п.) = Gл (qл + св tк.в.),
де Gп – маса продукту, в кг;
сп – питома теплоємкість продукту Дж/(кг · К);
tп.п. та tк.п – початкова та кінцева температури продукту, С;
Gл – маса льоду, кг;
qл – теплота фазового перетворення (теплота плавлення льоду), Дж /кг;
св – питома теплоємкість води, утвореної при плавленні льоду,Дж/(кг · К);
tк.в – кінцева температура цієї води, С.
Тепловий баланс при заморожуванні продукту можна представити у вигляді рівняння:
Qo.п. + Qз. + Qo.з. = Qх,
де Qo.п. – кількість теплоти, відданої продуктом при охолодженні від початкової до його кріоскопічної температури, Дж;
Qз ‑ кількість теплоти, відданої продуктом при фазовому перетворенні (заморожуванні) води (утворення льоду), Дж;
Qo.з. ‑ кількість теплоти, відданої продуктом при його охолодженні після заморожування, Дж;
Qх – кількість теплоти, прийнятої холодоносієм, Дж.
При охолодженні і заморожуванні тепловий потік направлений від центру до периферії, перенесення теплоти здійснюється завдяки конвекції та теплопровідності від продукту до навколишнього середовища.
Ефективність процесів заморожування і охолодження залежить від розмірів і форми продукту, які суттєво впливають на якість замороженої продукції.
Процес розморожування продукту відбувається із зміною його агрегатного стану – лід переходить у воду. Процес теплообміну при розморожуванні складається з двох стадій:
1. Підведення теплоти до замороженого продукту.
2. Перенесення теплоти за рахунок теплопровідності від периферії продукту до його центру.
На межі поділу теплоносія і продукту утворюється шар, в якому лід перейшов у воду. Цей шар збільшується по мірі нагрівання продукту від периферії до центру. перенесення теплоти при розморожуванні визначається коефіцієнтом теплопередачі.
Кількість теплоти, переданої від теплоносія до продукту, що розморожують, витрачається на плавлення льоду та на нагрівання продукту до необхідної температури:
K S Δtср τ = Gлqл + Gп (tк.п. – tп.п.),
де K – коефіцієнт теплопередачі: К = 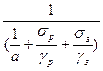 , дані для обчислення а, γ та К визначаються експериментально.
, дані для обчислення а, γ та К визначаються експериментально.
S – поверхня контакту продукту з теплоносієм, м2;
Δtср – середня різниця температур між продуктом і теплоносієм, С;
τ – тривалість процесу, с;
Gл – кількість розплавленого льоду, кг;
qл – теплота плавлення льоду, Дж/кг;
Gп – кількість продукту, що розморожують, кг;
tк.п. та tп.п – кінцева та початкова температури продукту, С.
Розморожування продуктів по можливості повинно проходити швидко. Установлено, що при швидкому заморожуванні правильно заморожений продукт значною мірою зберігає свої властивості, скорочуються втрати його маси. Практикою встановлено, що розморожування м’яса, риби, кисломолочного сиру необхідно проводити при температурі оточення 15 – 25 С.
¨ За своїм призначенням теплові машини поділяють на три основні типи:
ü теплові двигуни: поршневі, турбінні та реактивні; (трансформують теплоту в роботу. При виконанні роботи теплота від більш нагрітого тіла – нагрівача через робоче тіло передається більш холодному тілу – холодильнику).
ü теплові насоси (перетворюють теплоту нижчого потенціалу в теплоту вищого потенціалу і передають її споживачеві. За рахунок виконуваної роботи та теплоти, що відбирається з середовища (з меншою температурою), нагрівають тіла, які мають вищу температуру). Застосовують для потреб опалення.
ü холодильні машини: газові та парові (за типом робочих тіл). (Відбувається зворотний процес: передача теплоти від менш нагрітих тіл до більш нагрітих. Теплова енергія відбирається у тіл, що охолоджують і відводиться в оточуючий простір з більш високою температурою. Для здійснення такого процесу потрібно витратити енергію).
Холодильна машина – це тепловий двигун, що працює у зворотному напрямі.
Виробництво холоду нерозривно пов’язано з енергетикою. Штучне охолодження нижче температури зовнішнього середовища може відбуватися тільки із затратою енергії, що витрачається на привід холодильної машини. Залежно від холодопродуктивності потужність сучасних холодильних машин коливається в межах від декількох десятків ватт до тисяч кіловат енергії. Для зменшення використання енергії людство намагалось створювати холодильне обладнання з вищою енергетичною ефективністю, проте не замислювалось щодо екологічних аспектів експлуатації холодильної техніки. Широкого застосування набули у промислових і побутових холодильних установках, а також в кондиціюванні повітря фреонові парокомпресійні холодильні машини (ПКХМ) – високоефективні агрегати з простою елементною базою.
Основною проблемою використання ПКХМ є емісія (витікання) фреонів (використовуються як робоче тіло), що спричинило загострення глобальних проблем: зменшився озоновий шар Землі та збільшився „парниковий ефект”.
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 1309; Нарушение авторских прав?; Мы поможем в написании вашей работы!