
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
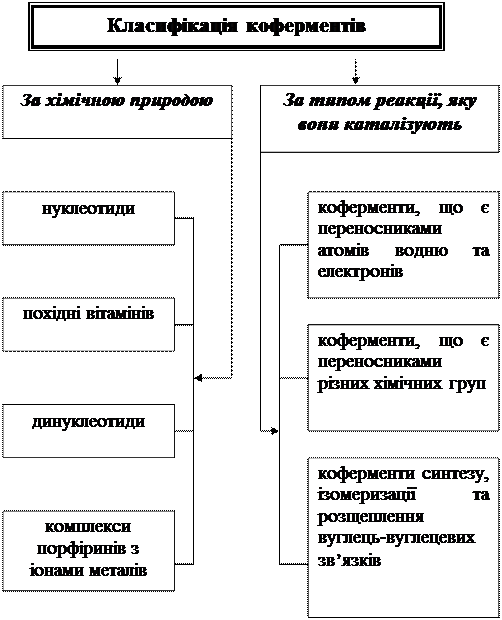
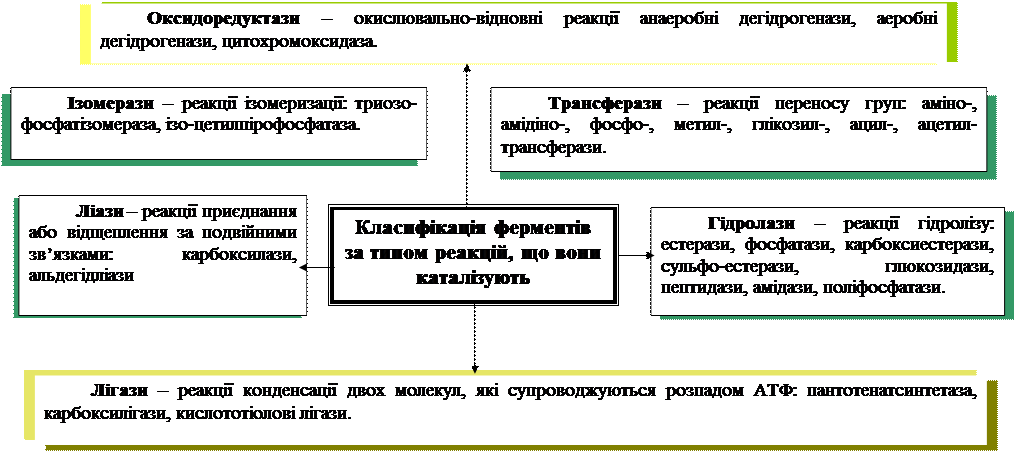
Властивості ферментів
|
|
|
|
1. Висока каталітична активність (фермент амілаза за 1хв. перетворює 1100000 молекул субстрату; 1 моль ферменту сахараза за 1 с здатен розщепити 1000моль бурякового цукру; 1г кристалів пепсину розщеплює 50кг коагульованого яєчного альбуміну; 1 г кристалічного реніну згортає 72т молока.
Каталітичну активність ферменту характеризують молекулярною активністю.
Молекулярна активність – число молекул даного субстрату або еквівалентів реагуючих груп, що перетворюються за 1 хв. однією молекулою ферменту при оптимальній концентрації субстрату.
2. Специфічність дії ферментів полягає в тому, що певний фермент діє лише на певну реакцію або групу реакцій, що відбуваються в організмі. Зумовлена конформаційною та електростатичною компліментарністю між молекулами ферменту; субстрату і структурою активного центру ферменту.
Специфічність:
Ä абсолютна специфічність (каталізують лише одну реакцію – фермент уреаза каталізує гідролітичне розщеплення сечовини на СО2 і NH3; фермент каталаза діє тільки на пероксид водню);
Ä абсолютна групова специфічність (каталізують певний тип реакції – пепсин, трипсин, хімотрипсин каталізують розщеплення пептидних зв’язків у білках і пептидах);
Ä відносна групова специфічність (каталізують розщеплення окремого типу хімічного зв’язку – фермент ліпаза гідролізує складноефірний зв’язок в будь-яких жирах);
Ä стереоізомерна, просторова специфічність (дія на цис-трансізомери або оптично активні сполуки – фермент дипептидаза прискорює гідроліз дипептидів, утворених залишками L-амінокислот; фермент α-глюкозиада діє тільки на α-глюкозиди, а фермент β-глюкозиада – тільки на β-глюкозиди).
|
|
|
3. Чутливість до температури (термочутливі та термолабільні).
При t>800С – денатурація білкового компонента, втрата активності ферментів. При низьких температурах – дія ферментів припиняється (не руйнуються);
Оптимальна активність ферментів: t = 37 – 400С (збільшення швидкості ферментативної реакції). Якщо при захворюванні температура тіла людини підвищилась до 39,5С, це свідчить про прискорення біохімічних процесів у 1,13 – 1,39рази (13-19%). Підвищення температури до 40-420С призводить до швидкого зниження біохімічного процесу у зв’язку з денатурацією та інактивацією ферментів.
4. Чутливість до рН середовища (зумовлена іонізацією активного центру, субстрату і кофакторів, що впливає на формування активного фермент-субстратного комплексу). Кожний фермент має свій рН-оптимум, тобто значення рН середовища, при якому його каталітична активність максимальна.
Оптимальні значення рН для:
| Ø пепсину 1,5–2,5; Ø трипсину 7,5-8,5; Ø хімозину 6,0; | Ø кишкової мальтази 5,8-6,1; Ø амілази слини 6,8-7,0; Ø панкреатичної ліпази 7,0-8,5. |
Активатори ферментів (підвищують активність ферментів) – кислоти НСІ і жовчні, катіони металів (Са2+, Mg2+, Со2+, Сu2+), аніони (СІ-).
Інгібітори (знижують активність ферментів), розрізняють:
a оборотне гальмування (утворення слабкого комплексу, який має здатність розпадатися з вивільненням ферменту);
a необоротне гальмування (міцний комплекс, поступове зв’язування і вилучення ферменту із середовища).

| 
|
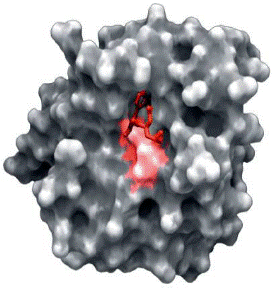
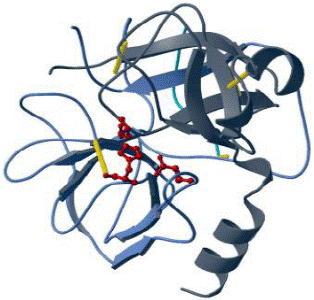
| Активний центр ферменту хімотрипсину |

 | |||
 |
Застосування ферментів. Ферменти впливають на якість сировини (плоди, овочі, борошно, м’ясо) і готової продукції. Використовуються для визрівання м’яса, покращення його консистенції, смаку, аромату, для виготовлення м’ясних паштетів, покращення відокремлення м’яса від кісток, збільшення термінів зберігання м’ясних продуктів.
|
|
|
При виробництві пива і квасу використання ферментних препаратів дозволяє зменшувати витрати солоду. Ферменти прискорюють процес дозрівання сирів.
Негативна функція: наявність активних ферментів при зберіганні продуктів може спричинити зниження харчової цінності. Наприклад, у крах маловмісних продуктах активна амілаза спричиняє деградацію крохмалю, знижує хлібопекарські якості борошна; зменшення вмісту лізину (пшениця) при дії протеолітичних ферментів; при зберіганні на повітрі очищеної картоплі активна о-дифенолоксидаза каталізує процес утворення темного пігменту на поверхні картоплі.

|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 2379; Нарушение авторских прав?; Мы поможем в написании вашей работы!