
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Абсолютна швидкість і рухливість іонів. Закон Кольрауша
|
|
|
|
У розчинах сильних електролітів електрична провідність залежить від концентрації: зростає з розведенням розчину, так як зменшується число іонів в одиниці об’єму розчину та збільшується їх швидкість за рахунок ослаблення гальмування іонами протилежного знаку.
У розчинах слабких і сильних електролітів (провідники ІІ роду) електрична провідність зростає з підвищенням температури завдяки ослабленню міжіонних взаємодій.
λ∞ = λ+ + λ-
Закон Кольрауша, 1875р. (закон адитивності граничної молярної електропровідності, або закон незалежності руху іонів): питома молярна електрична провідність λ∞ розчину електроліту дорівнює сумі питомих молярних рухомостей аніонів і катіонів λ+ + λ-, що входять до складу електроліту.
Електролітична рухливість іона є величина стала для кожного іона, вона пропорційна його абсолютній швидкості і залежить від температури та природи розчинника. Рухливість іона дорівнює добутку його абсолютної швидкості U на сталу Фарадея F: λ+ = F · U+;
λ- = F · U-,
де F = 96500 Кл/моль;
U+ та U- ‑ абсолютна швидкість руху іонів, тобто швидкість руху іонів у нескінченно розведеному розчині, в 1м/с при спаді потенціалу поля в 1 В/м; розмірність U+ та U 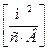
Тому рівняння можна записати таким чином: λ∞ = F · U+ + F · U- = F (U+ + U-)
Найбільшу рухливість у воді мають іони Н3О+ і ОН-. Пояснення: рух протона під впливом електричного поля відбувається двома шляхами: рухом разом зі своєю гідратною оболонкою у напрямку поля та перестрибуванням по водневому зв’язку від однієї молекули до іншої у тому ж напрямі. При цьому швидкість перескакування значно більша за швидкість поступального руху, внаслідок цього швидкість руху іонів гідроксонію дуже висока. Протони проходять не весь шлях до катода, а тільки відстань між молекулами води. Вони нібито передаються по естафеті від однієї молекули води до другої, тому такий механізм пересування іонів названий естафетним.
|
|
|
Рух іонів ОН- пояснюється таким самим механізмом, однак при цьому протон передається від молекули води до гідроксильного іона. У результаті цей процес виглядає як переміщення гідроксильних іонів до анода.
Для інших іонів такий спосіб переміщення у водних розчинах є малоймовірним через значні розміри цих іонів. Протони мають дуже малі розміри, і перехід від однієї молекули води до другої мало змінює структуру води.
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 1136; Нарушение авторских прав?; Мы поможем в написании вашей работы!