
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металла в энергоустановках
|
|
|
|
В энергетике встречается несколько видов коррозии, которую подразделяют на две группы.
1. Электрохимическую - если коррозия сопровождается появлением электрического тока (например: сернистая коррозия хвостовых поверхностей нагрева);
2. Химическую - например: окалинообразование, кислородная коррозия водяных экономайзеров.
Существуют несколько видов коррозии:
1) сплошная (рис.4.1,а),
2) коррозия пятнами (рис.4.1,б),
3) язвенная коррозия (рис.4.1,в),
4) межкристаллитная коррозия (рис.4.1,г).
 |
Рис.4.1. Видимая структура коррозии
Электрохимическая коррозия - это процесс растворения металла в электролите. При соприкосновении металла с электролитом происходит взаимодействие аниона электролита с ионом металла, в результате чего ион металла покидает кристаллическую решетку, оставляя в ней свободный электрон. Поэтому металл заряжается отрицательно, а раствор электролита положительно. Возникающая на границе раздела разность потенциалов и характеризует способность металла к растворению.
Стойкость металла против электрохимической коррозии оценивается по его электродному потенциалу. Электродный потенциал определяется как разность потенциалов металла и водорода при условии, что металл соприкасается с нормальным раствором сернокислой соли этого же металла при 20 0С.
Наиболее легко растворяются элементы, имеющие отрицательный электродный потенциал; причем растворение происходит тем интенсивнее, чем меньше величина электродного потенциала.
Например, для Н - электродный потенциал 0
для Fe - 0,44
для Ni - 0,23
для Cu + 0,334
для серебра + 0,8
для золота + 1,36
Отрицательный электродный потенциал стали увеличивается при приложении к ней механического напряжения и при пластической деформации.
|
|
|
Кроме того, различный химический состав металла в различных местах детали вызывает появление гальванических элементов и химических процессов.
Если металл и электролит имеют одинаковый химический состав по всей поверхности соприкосновения их, то в реакции растворения наступает равновесие и коррозия прекращается.
Следовательно, основной причиной электрохимической коррозии является неоднородность строения металла: ликвации, наличие нескольких фаз и др.
Химическая коррозия в котлах происходит не только в результате взаимодействия металла со свободным кислородом и углекислым газом, но и за счёт реакции с водяным паром и дымовыми газами. Поэтому в котлах проявляется несколько видов химической коррозии.
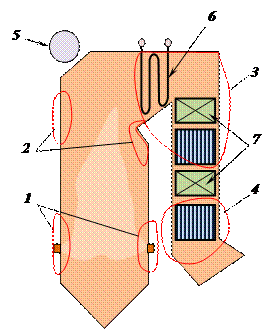 |
В энергетике коррозии особенно подвержены поверхности нагрева котлов, поскольку в них есть как водная среда, так и повышенные температуры. На котлах существует активная окислительная среда. Коррозия протекает как на внутренних, так и на наружных поверхностях нагрева. На рис.4.2 показаны различные виды коррозии, возникающие как на внутренних, так и на наружных поверхностях нагрева котла.
Рис.4.2. Места и наименование коррозии на элементах котла; 1 - высокотемпературная коррозия металла; 2 – ванадиевая коррозия; 3 – газовая коррозия; 4 - низкотемпературная сернистая коррозия; 5 – коррозия в барабанах (щелочная, под шламом и др.); 6 – пароводяная коррозия; 7 – кислородная коррозия.
1. Низкотемпературная сернистая коррозия проявляется в хвостовых наружных поверхностях нагрева парогенератора - в воздухоподогревателях. При сжигании топлив, содержащих серу, в котле образуются окислы серы SO3, которые при охлаждении газов до точки росы, растворяются в водяных парах, образуют слабый раствор серной кислоты, которая оседает на поверхностях нагрева и быстро разъедает их.
|
|
|
Для снижения интенсивности сернистой коррозии применяют щелочные присадки в топливо (магнезит, доломит, известь).
2. Кислородная коррозия возникает в водяном экономайзере, когда пузырьки воздуха, неудаленного полностью при деаэрировании питательной воды, осаждаются на внутренней поверхности труб и кислород реагирует с металлом. При длительном воздействии кислорода коррозия проявляется в виде углублений, которые могут развиться в свищи. Кислородная коррозия металла усиливается с повышением давления и температуры воды, а так же при повышении содержания в ней кислорода. Поэтому содержание кислорода в питательной воде строго ограничено (например: для котлов высокого давления содержание кислорода не должно превышать 15 мг/м3). Скорость кислородной коррозии можно так же уменьшить за счёт добавки в питательную воду едкого натрия, фосфата и др., которые растворяясь в воде, способствуют образованию на поверхности металла защитной пленки, затрудняющей соприкосновение металла и кислорода. Это позволяет снизить общую интенсивность коррозии, но не полностью избавиться от нее, так как очагами коррозии в этом случае служат различные дефекты поверхности металла (например, трещины).
3. Пароводяная (водородная) коррозия. Химически чистый водяной пар разлагается при температурах порядка 10000С. Таких температур пара в современных котлах не достигается, однако в присутствии катализаторов (например: железо, растворенное в воде) диссоциация начинается при более низких температурах. Так при температурах выше 300-400 0С железо, входящее в состав воды, вступает в реакцию с водой:

Свободный водород, который выделяется в результате этой реакции, насыщает сталь, а магнетит  отлагается на поверхностях труб в виде пленки, которая затормаживает дальнейшее развитие коррозии углеродистых сталей до температуры 450-500 0С. Сталь, насыщаясь водородом, становится хрупкой. Если скорость пара больше 10 м/сек, то свободный водород уносится вместе с паром и коррозия практически не проявляется. Кроме того, стали, содержащие хром и молибден, не подвержены пароводяной коррозии.
отлагается на поверхностях труб в виде пленки, которая затормаживает дальнейшее развитие коррозии углеродистых сталей до температуры 450-500 0С. Сталь, насыщаясь водородом, становится хрупкой. Если скорость пара больше 10 м/сек, то свободный водород уносится вместе с паром и коррозия практически не проявляется. Кроме того, стали, содержащие хром и молибден, не подвержены пароводяной коррозии.
|
|
|
3. Газовая коррозия (окалинообразование). В результате окисления стали на поверхности деталей образуется пленка окислов. Если эта пленка прочно связана с основным металлом, то она препятствует соприкосновению металла с кислородом и для продолжения реакции необходима диффузия через плёнку окислов, ионов металла или ионов кислорода. Чем плотнее кристаллическая решётка пленки окислов, тем труднее диффузия ионов через неё и тем медленнее идет процесс окисления.
При температурах меньших 350 0С окислы, покрывающие металл, состоят из гемотита - 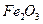 , окисла с наибольшим содержанием кислорода.
, окисла с наибольшим содержанием кислорода.
При температурах больше 400 0С на внутренней стороне пленки возникает слой магнетита 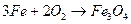 .
.
При более высоких температурах (t > 570 0С) между окисной пленкой и поверхностью металла образуется слой вюстита с наименьшим содержанием кислорода:

Содержание кислорода от слоя к слою изменяется скачкообразно, как показано на рис.4.3.
 |
Рис.4.3. Слои коррозии, возникающие на металле при повышенных температурах
Вюстит является твердым раствором вычитания и диффузионные процессы в нем облегчены, т.к. в кристаллической решётке FeО имеются свободные узлы. Следовательно, для увеличения окалиностойкости сталей, их необходимо легировать элементами, у которых плёнка окислов имела бы более плотную кристаллическую решётку, чем у окислов железа.
Основной причиной повышения окалиностойкости легированных сталей является более высокая температура образования вюстита. Концентрация легирующих элементов во внутреннем слое окалины должна быть достаточной для предупреждения образования вюстита (при расчетной температуре).
Таким образом, окалиностойкость сталей определяется свойствами окисной плёнки, образующейся на поверхности детали, а именно, её прочностью и плотностью сцепления с основным металлом. Плотные кристаллические решётки имеют окисные плёнки хрома, кремния, алюминия, поэтому с увеличением их содержания в стали повышается её окалиностойкость.
4. Щелочная хрупкость. Коррозия протекает в барабанах котлов в виде трещин, которые распространяются по границам зерен при наличии щелочной среды. Разрушение металла происходит без заметных следов пластической деформации, хотя углеродистые стали барабанов котлов имеют высокую ударную вязкость. Необходимым условием щелочной хрупкости является наличие в металле больших и небольших начальных трещин или щелей; металл разрушается по границам зёрен феррита, лежащих, у этих трещин.
|
|
|
Разрушение металла вследствие щелочной хрупкости происходит только в том случае, когда металл подвержен механическим напряжениям, которые способствуют постепенному увеличению щелей и трещин.
Известно, что щелочная коррозия развивается быстрее с уменьшением углерода и с повышением температуры.
Для предупреждения щелочной коррозии необходимо, чтобы в конструкциях барабанов котлов не было узлов, облегчающих повышение щелочности котловой воды, а так же недопустимо омывание щелочной котловой водой наклепанного металла и мест с высокой концентрацией напряжений.
Стойкости от щелочной хрупкости можно достичь изменением электрохимических свойств котловой воды добавкой специальных примесей - пассиваторов.
5. Коррозионное растрескивание (коррозия под напряжением) возможно не только в барабанах котлов. Этот вид разрушений наблюдается у сталей любого элемента котла, находящегося в условиях коррозионной среды. Он выражается в появлении трещин преимущественно внутрикристаллитного характера и протекает наиболее интенсивно при наличии напряжений. Благодаря приложению напряжения даже в упругой области работы стали она становится электрохимически более отрицательной и это увеличивает скорость коррозии.
Для борьбы с этим видом коррозии можно рекомендовать применение пассиваторов смещающих отрицательную, электрохимическую коррозию в сторону положительных электродных потенциалов.
Скорость корроизонного растрескивания зависит от температуры, от среды и от вида стали. Например, аустенитные стали в присутствии  обладают значительной склонностью к коррозионному растрескиванию.
обладают значительной склонностью к коррозионному растрескиванию.
6.
 |
Межкристаллитная коррозия аустенитных сталей. Аустенитная сталь рассматривается как трехэлектродная система. Аустенитные зерна и карбиды хрома и железа на границах зерен являются катодами по отношению к объедененным хромом пограничным зонам аустенитных зерен, которые являются анодами. Между электродами возникают гальванические токи. Межкристаллитная коррозия развивается в узких зонах по границам зерен, ослабляя связь между ними, (рис.4.4)
Рис.4.4. Схема образования межкристаллитной коррозии
Для увеличения стойкости аустенитных сталей к межкристаллитной коррозии необходимо избавиться от карбидов хрома и железа. Для этого в сталь вводят элементы титана и ниобия, которые сами образуют карбиды более легкие, чем хромистые карбиды.
Хром же оказывается в виде твердых растворов.
7. Сернистая коррозия никелевых сталей. Сера, находящаяся в дымовых газах, образует с никелем сульфиды 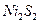 , которые образуют легкоплавкую эвтектику. Температура плавления 624 0С. Поэтому эта эвтектика быстро разрушается под действием высокой температуры уходящих газов. Образование сульфидов начинается при температуре более 900 0С. Поэтому никелевые стали не рекомендуют применять при температурах больших 800 0С.
, которые образуют легкоплавкую эвтектику. Температура плавления 624 0С. Поэтому эта эвтектика быстро разрушается под действием высокой температуры уходящих газов. Образование сульфидов начинается при температуре более 900 0С. Поэтому никелевые стали не рекомендуют применять при температурах больших 800 0С.
8. Ванадиевая коррозия. Этому виду коррозии подвергаются аустенитные стали котлов при сжигании высокозольных сернистых мазутов, которые содержат большое количество ванадия и сернистого натрия. На металле откладываются отложения  и соединения
и соединения  , который является катализатором. Механизм ванадиевой коррозии описывается уравнениями:
, который является катализатором. Механизм ванадиевой коррозии описывается уравнениями:
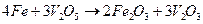




Наиболее интенсивно коррозия протекает в интервале температур 625 - 750 0С при содержании в отложениях 87%  и 13%
и 13%  .
.
Интенсивность возрастает с увеличением температуры и длительности работы стали. Содержание молибдена в стали ускоряет коррозию при t > 750 ° С. После достижения максимального значения скорость коррозии уменьшается.
Ванадиевая коррозия разрушает не только металл поверхностей нагрева и стоек, но и футеровку топочной камеры и газоходы.
Для борьбы с ванадиевой коррозией можно рекомендовать легирование металлов хромом, кремнием, никелем, но не для аустенитных сталей. Можно рекомендовать защитные покрытия (плёнки) Надежной защиты от ванадиевой коррозии пока нет.
Кроме перечисленных видов коррозии встречаются и другие виды электрохимической коррозии, например, коррозия под слоем шлама.
Считается, что как только осваиваются новые параметры пара или новые топлива, то сразу энергетика сталкивается с новыми видами коррозии. Например. Как только начали осваивать атомную энергию, то на энергоблоках АЭС появилась радиационная коррозия.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 2202; Нарушение авторских прав?; Мы поможем в написании вашей работы!