
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 1. Менеджмент как вид деятельности
|
|
|
|
Основные понятия и определения химической термодинамики. Первое начало термодинамики
ТЕМА 2. ТЕРМОДИНАМИКА
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
Термодинамика возникла как наука о взаимных превращениях теплоты и работы при создании тепловых машин. Различают общую, техническую и химическую термодинамику.
В общей термодинамике излагают теоретические основы термодинамики и рассматривают их использование при объяснении физических явлений. Задачи технической термодинамики связаны с разработкой теории тепловых двигателей на основе законов термодинамики.
Химическая термодинамика изучает положения и законы общей термодинамики применительно к химическим явлениям. Она исследует тепловые балансы процессов, фазовые равновесия в системах, состоящих из индивидуальных веществ или смесей, химические равновесия, позволяет теоретически предсказать принципиальную невозможность того или иного процесса, либо указать его направление. Термодинамика рассматривает лишь те тела, которые состоят из большого числа молекул, – макроскопические системы, отдельные частицы не являются предметом ее исследования.
Термодинамический метод является одним из важнейших при изучении влияния различных факторов на химическое взаимодействие и установления взаимосвязи между различными свойствами химических систем. Кроме того, велико его значение для химии как средства проверки правильности закономерностей, найденных иным, не термодинамическим путем, поскольку всякая закономерность должна быть совместима с требованиями термодинамики.
|
|
|
Объектом изучения термодинамики выступают изолированные, закрытые и открытые системы.
Система, которая не обменивается энергией и веществом с окружающей средой, называется изолированной. Поскольку такую систему реально осуществить трудно, ее можно представить как некоторую идеальную модель.
Закрытой называется система, которая обменивается с окружающей средой энергией, но не обменивается веществом. Классический пример закрытой системы – газ, находящийся под движущимся поршнем.
Открытые системы обмениваются с окружающей средой и энергией, и веществом. Все живые организмы – открытые системы.
Различают гомогенные и гетерогенные системы. Гомогенная система содержит одну фазу, гетерогенная – две и более.
Фаза – это совокупность частей системы с однородными физическими и химическими свойствами, одинаковой энергией. Эта часть системы отделена от других частей видимой поверхностью раздела. Если фаза состоит из одного вещества, то она называется простой, например, вода, спирт, кислота, соль. Смешанная фаза включает два и более вещества, например, растворы неэлектролитов и электролитов, расплавы.
Газ или смесь газов всегда образует одну фазу. Полностью смешивающиеся жидкости – гомогенные системы, ограниченно растворимые жидкости в области расслоения – гетерогенные. Кристаллы одного вещества представляют собой одну фазу, например, соль, лед. При наличии нескольких веществ могут быть получены кристаллические однофазные системы, если результатом кристаллизации являются твердые растворы замещения или внедрения, или многофазные системы, например, механическая смесь кристаллов различных веществ.
Состояние системы характеризуется величинами, которые называются параметрами. Термодинамический параметр – это независимая переменная, отражающая какое-либо свойство системы и определяющая ее состояние. Параметры состояния, которые можно установить непосредственно, экспериментально, принято называть основными. Ими являются температура T, давление P, плотность ρ, концентрация вещества C, молярный объем Vм.
|
|
|
Макроскопические параметры системы, которые зависят от положения внешних по отношению к ней тел, называются внешними, а те, которые зависят от состояния частиц внутри системы – внутренними. Примеры внешних параметров – объем системы, давление, внутренних – концентрация, плотность вещества.
Среди свойств системы различают экстенсивные и интенсивные. Экстенсивные зависят от количества вещества. К ним относятся объем, масса, внутренняя энергия, энтропия и т. д. Интенсивные величины не зависят от количества вещества и имеют тенденцию к выравниванию по всему объему системы. Это температура, концентрация, потенциалы и т. д.
Если с течением времени все или некоторые параметры системы изменяются, то система изменяет свое состояние – протекает процесс. Чаще всего протекают следующие процессы:
изотермический (T = const);
изобарный(P = const);
изохорный(V = const);
адиабатический (нет обмена теплотой между системой и внешней средой);
изобарно-изотермический (P = const, T = const);
изохорно-изотермический (V = const, T = const).
Процесс, в результате которого система, выйдя из начального состояния и претерпев ряд превращений, вновь в него возвращается, называется круговым процессом.
Из одного состояния (начального) в другое (конечное) система может перейти различными путями, т. е. через различные промежуточные состояния. Рассмотрим для примера систему, состоящую из 1 моль газообразного водорода. Пусть состояние этой системы характеризуется следующими значениями свойств:
| Свойство | Начальное состояние | Конечное состояние |
| P, ГПа | ||
| T, °С | ||
| V, м3 | 0,0224 | 0,0112 |
Эти состояния можно изобразить на PV -диаграмме точками А и В (рис. 2.1).
Из начального состояния А в конечное В систему можно перевести при T = const (путь АВ). Однако можно сделать это и по пути АСВ, т. е. сначала охлаждая газ при P = const (линия АС), а потом нагревая его до начальной температуры при V = const (линия СВ).
|
|
|
Можно также газ, находящийся в состоянии А, нагреть при V = const (линия AD), а затем охладить при P = const (линия DB) и, таким образом, перевести газ из А в В по пути ADB.
Иными словами, можно перевести газ из состояния А в В с помощью бесконечного множества различных процессов, но в конечном состоянии он будет обладать всегда одними и теми же свойствами, независимо от его «истории». Следовательно, свойства системы есть функция только ее состояния.
При изучении изменения свойств системы, когда она переходит из исходного состояния в конечное, отличное от исходного, используется метод функций. Различают функции состояния и функции процесса.
Функция состояния зависит только от параметров системы и не зависит от пути процесса, по которому система пришла в данное состояние. Бесконечно малое изменение этих функций есть полный дифференциал. Чтобы найти изменение такой функции В при переходе системы из состояния 1 в состояние 2, нужно найти интеграл
 (2.1)
(2.1)
Таким образом, изменение функции состояния ∆В равно разности значений этой функции в обоих состояниях (В2, В1).
Функции процесса зависят от пути, по которому идет данный процесс. Бесконечно малое изменение такой функции δА не является полным дифференциалом. Чтобы определить значение функции процесса при переходе из состояния 1 в состояние 2, необходимо сложить бесконечно малые изменения δ А:
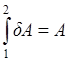 (2.2)
(2.2)
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения. Эти формы могут превращаться друг в друга. В превращениях, происходящих в ходе химических реакций, участвуют, как правило, тепловая энергия Q и механическая (или работа A). Единица измерения энергии и работы – джоуль, Дж.
Тепловая и механическая энергия – алгебраические величины. Знаки величин Q и A в термодинамике рассматриваются по отношению к системе. Энергия, получаемая системой, обозначается знаком «+», отданная системой, знаком «‑».
Работа будучи всегда связанной с преодолением сопротивления есть не свойство системы, а макрофизическая, т. е. упорядоченная форма передачи энергии от системы, совершающей работу, к системе, над которой она совершается. Работа есть функция процесса. В термодинамике принято считать работу, производимую системой над средой, положительной. Когда работа производится внешними силами над системой, она считается отрицательной.
|
|
|
Работа расширения – это работа против внешних сил, т. е.
 (2.3)
(2.3)
Рассмотрим несколько примеров расчета работы расширения для системы, представляющей собой газ, который находится под движущимся поршнем:
1) Пусть рвнеш = const, а рвнутр. > рвнеш. (например, пусть внешнее давление равно атмосферному, а газ под поршнем образуется в результате какой-нибудь химической реакции). В итоге система совершит над окружающей средой работу, равную работе расширения:
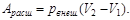 (2.4)
(2.4)
2) Пусть рвнеш = const, а рвнутр. < рвнеш. (например, пусть давление равно атмосферному, а газ под поршнем поглощается каким либо телом). В этом случае наблюдается процесс сжатия системы, над которой производится работа со стороны окружающей среды:
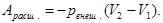 (2.5)
(2.5)
3) Если рвнеш = 0, то А расш. = 0, т.е. работа расширения в вакууме равна нулю.
Как и работа, теплота Q есть функция процесса. Это форма передачи энергии между системами вследствие хаотического (теплового) движения частиц. Обмен зависит от температуры соприкасающихся тел и продолжается до тех пор, пока не установится состояние теплового равновесия, при котором температуры тел выравниваются.
Согласно нулевому закону термодинамики, если одно тело находится в термическом равновесии с другим и третьим телом, то два последних тела находятся в термическом равновесии между собой. На этом утверждении основан способ измерения температуры тела с помощью термометра.
Подводимую к системе Q принято считать положительной, а отданную системой – отрицательной. Теплота зависит от давления р, температуры Т и объема V системы.
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией.
Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты – эндотермическими. Теплоты реакций являются, таким образом, мерой изменения свойств системы, и знание их может иметь большое значение при определении условий протекания тех или иных реакций.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы – закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии ∆U и на совершение работы A:
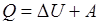 (2.6)
(2.6)
Внутренняя энергия системы U – это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных атомов и атомных групп, энергию движения электронов и т.д. Внутренняя энергия – полная энергия без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого.
Абсолютное значение внутренней энергии U веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как любой вид энергии, является функцией состояния, т.е. её изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс
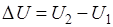 ,
,
где ∆U – изменение внутренней энергии системы при переходе от начального состояния U1 в конечное U2. Если U2>U1, то ∆U>0. Если U2<U1, то ∆U<0.
При химических реакциях A – это работа против внешнего давления, т.е. в первом приближении 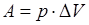 , где ∆V – изменение объема системы (∆V<0, если система получает работу, ∆V>0, если система совершает работу против внешних сил).
, где ∆V – изменение объема системы (∆V<0, если система получает работу, ∆V>0, если система совершает работу против внешних сил).
Так как большинство химических реакций проходит при постоянном давлении, то для изобарно-изотермического процесса (p = const, T = const) теплота будет равна:
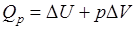
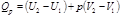
 ).
).
Сумму 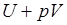 обозначим через H, тогда
обозначим через H, тогда
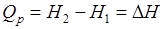 . (2.7)
. (2.7)
Величину H называют энтальпией. Таким образом, теплота при (p = const, T = const) приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции в изобарно-изотермическом процессе Qp равна изменению энтальпии системы ∆H (если единственным видом работы является работа расширения): 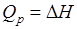 .
.
Энтальпия, как и внутренняя энергия, является функцией состояния; её изменение (∆H) определяется только начальным и конечным состоянием системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно – изотермическом процессе (V = const, T = const), при котором ∆V = 0, равна изменению внутренней энергии системы: 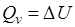 .
.
Теплоты химических процессов, протекающих при p,T = const и V,T = const, называют тепловыми эффектами.
При экзотермических реакциях энтальпия системы уменьшается и ∆H < 0 (H 2 < H1), а при эндотермических – энтальпия системы увеличивается и ∆H >0 (H 2 > H1). В дальнейшем тепловые эффекты всюду выражаются через ∆H.
Исходя из выражений 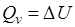 ,
,  и
и 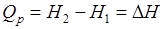 получаем
получаем
 (2.8)
(2.8)
Из уравнения газового состояния 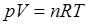 следует, что
следует, что 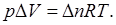 Значит, для реакции между идеальными газами
Значит, для реакции между идеальными газами
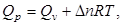
(2.9)
где 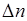 – разность между количеством образовавшихся газообразных продуктов и количеством исходных газообразных веществ.
– разность между количеством образовавшихся газообразных продуктов и количеством исходных газообразных веществ.
При невысоких температурах слагаемое 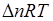 обычно мало по сравнению с
обычно мало по сравнению с 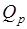 и
и  . Для реакций, у которой
. Для реакций, у которой  , например Н2 + Сl2 → 2 НСl, справедливо
, например Н2 + Сl2 → 2 НСl, справедливо 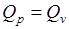 .
.
Понятие менеджмента, принципы менеджмента, функции менеджмента, характеристика труда менеджера, структура труда менеджера, соотношение функций менеджера и уровней управления.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 313; Нарушение авторских прав?; Мы поможем в написании вашей работы!