
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виды химической связи. Геометрическая форма отдельных молекул на основе теории гибридизации и структура молекул неорганических и органических веществ
|
|
|
|
ЛЕКЦИЯ №6.
Высшими центрами вегетативной регуляции являются
ПЕРЕДНИЙ ГИПОТАЛАМУС ® трофотропные центры (парасимпатические)
ЗАДНИЙ ГИПОТАЛАМУС ® эрготрофные центры (симпатические)
СРЕДНИЙ ГИПОТАЛАМУС ® центры обмена веществ и терморегуляции
ЛИМБИЧЕСКАЯ СИСТЕМА ® центры интеграции вегетативных и соматических функций, эмоциональных реакций
КОРА ГОЛОВНОГО МОЗГА ® центры условных рефлексов, организации поведения
Как мы уже рассмотрели с вами в предыдущей лекции, химическая связь бывает различных видов: ковалентная (полярная и неполярная) ионная, металлическая и т.д.
Ковалентная связь, как и донорно-акцепторная химическая связь образуется между атомами, расположенными в пространстве друг относительно друга определенным образом – направленно. Это вызвано необходимостью наибольшего перекрывания волновых функций (атомных орбиталей) электронов. По-видимому, чем сложнее конфигурации атомных орбиталей, тем больше возможно вариантов их взаимных перекрываний.
По виду перекрывания волновых функций электронов – связи обозначаются строчными греческими буквами σ, π, d, φ и т.д. созвучно с латинскими s, p, d, f и т.д., обозначающими те атомные орбитали, которые определяют характер симметрии связи.
σ связи и π-связь мы разобрали в предыдущей лекции.
Направленность ковалентных связей в пространстве придает многоатомным частицам (радикалам, молекулам, ионам) определенную форму – конфигурацию. От неё зависит внутренняя структура вещества, а следовательно, и его свойства. Поэтому вопрос о расположении в пространстве атомных орбиталей и об их взаимном влиянии требует рассмотрения.
Чем полнее в пространстве перекрываются друг с другом две атомные орбитали, участвующие в химической связи, тем меньшим запасом энергии обладают электроны, находящиеся в области перекрывания и осуществляющие связь между этими атомами.
|
|
|
При образовании молекулы вместо исходных атомных s, p, d, f – формы образуются такие равноценные «смешанные» орбитали или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии.
Но более полное перекрывание электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии.
Например: рассмотрим молекулу BeF2, ZnCl2, CdCl2, HgJ2 и т.д.
 |

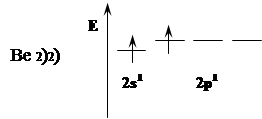 Be в невозбужденном состоянии неспаренных электронов не имеет. При «распаривании» т.е. переходе в возбужденное состояние образуется 1s22s12p1 т.е. образуются 2 неспаренных электрона.
Be в невозбужденном состоянии неспаренных электронов не имеет. При «распаривании» т.е. переходе в возбужденное состояние образуется 1s22s12p1 т.е. образуются 2 неспаренных электрона.
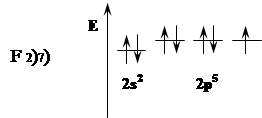 У фтора один неспаренный электрон в форме р.
У фтора один неспаренный электрон в форме р.
Молекула состоит из одного атома бериллия и двух атомов фтора.
 F – Be – F
F – Be – F
Вместо исходных s и p орбиталей атома бериллия могут образоваться две равноценные гибридные орбитали (sp). Образующие более вытянутые формы sp орбиталей образуют более прочную связь и энергетически более выгодную. Этот процесс называется sp – гибридизацией. 2 орбитали будут направлены друг к другу под углом в 180˚ и иметь противоположные знаки (+) и (-).
sp2 – гибридизация.
Три различные атомные орбитали (АО), комбинируясь друг с другом, образуют 3 одинаковые гибридные орбитали. Получаются три равноценные гибриды, расположенные под углом в 120˚ относительно центра координат. В качестве примера можно привести молекулы Ga, Zn, Te с галогенами и также бора.
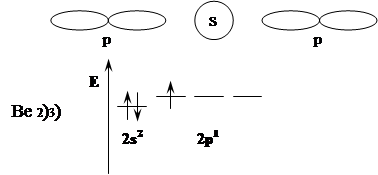 | ||||||
 | ||||||
| ||||||
 |
|
|
|
Образуются три равноценные орбитали. Образуют правильный треугольник.
В молекуле органических соединений, например в этилене, - sp2 гибридизация.
sp3 – гибридизация
Гибридизация одной s и трех p – орбиталей характерна для углерода, Si и германия. Гибридные sp3 орбитали на ¼ имеют характер s – орбитали и на ¾ - p – орбитали, поэтому у них более вытянутая форма, чем у sp2 – орбиталей, и от центра атома они расходятся под углами 109˚ к вертикали тетраэдра.
Подобный тип гибридизации имеется в атомах С- углерода, азота в NH4+; TiCl4 и др. Из органических веществ в этане, метане (CH4).
 Рассмотрим также молекулу воды. При её образовании происходит sp3 – гибридизация атомных орбиталей кислорода. Именно поэтому валентный угол в НОН равен 104˚, т.е. ближе к 109˚, чем к 90˚. Отличие от 109˚ можно понять, если учесть неравноценность состояния электронных облаков, окружающих атом кислорода в молекуле воды.
Рассмотрим также молекулу воды. При её образовании происходит sp3 – гибридизация атомных орбиталей кислорода. Именно поэтому валентный угол в НОН равен 104˚, т.е. ближе к 109˚, чем к 90˚. Отличие от 109˚ можно понять, если учесть неравноценность состояния электронных облаков, окружающих атом кислорода в молекуле воды.
В молекуле воды только четыре из восьми электронов, занимающих гибридные sp3 орбитали атома кислорода образуют связи О – Н, а две электронные пары остаются неподеленными, т.е. принадлежат только атому кислорода.
 |
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1193; Нарушение авторских прав?; Мы поможем в написании вашей работы!