
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные уравнения для парциальных молярных величин
|
|
|
|
Парциальные молярные величины компонентов раствора взаимосвязаны. Так, если известна зависимость давления пара одного из компонентов бинарного раствора от его концентрации, то можно вычислить давление пара другого компонента. Это позволяет существенно сократить число экспериментальных определений, необходимых для термодинамической характеристики растворов.
Уравнения, связывающие парциальные молярные величины с составом раствора, носят названия уравнений Гиббса-Дюгема.
Так величина какого-либо свойства раствора равна:

где  – парциальная молярная величина компонента, n1, n2 – число молей 1 -го, 2 -го и т.д. компонентов в растворе.
– парциальная молярная величина компонента, n1, n2 – число молей 1 -го, 2 -го и т.д. компонентов в растворе.
Или
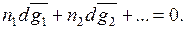
Если разделить это уравнение на 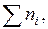 получим соотношение, в которое входят мольные доли:
получим соотношение, в которое входят мольные доли:

Разделив данное уравнение на 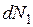 при постоянстве р общ, и T, получим уравнение
при постоянстве р общ, и T, получим уравнение
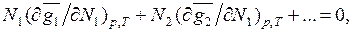
связывающее между собой парциальные молярные величины компонентов раствора.
Для бинарного раствора 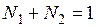 и
и 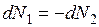

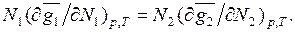 (6.10)
(6.10)
Таким образом, если измерена величина  как функция
как функция 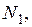 то можно рассчитать
то можно рассчитать  Например,
Например,
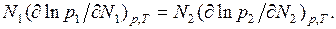 (6.11)
(6.11)
Это важное уравнение связывает давление паров компонентов раствора и позволяет из измерений давлений пара одного компонента над раствором рассчитать давление пара второго компонента. Данное уравнение справедливо для любых растворов.
Зависимость парциальных молярных величин от концентрации могут иметь сложный характер. Например, на рис. 6.2 показана зависимость молярных объемов жидких сплавов магния и кадмия от состава. Изменение этих величин для одного моля сплава описывается кривой с максимумом и минимумом.
Пунктирная прямая, которая соединяет точку, соответствующую мольному объему чистого кадмия 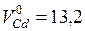 см3/моль, с точкой для чистого магния
см3/моль, с точкой для чистого магния 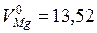 см3/моль, отвечает идеальному случаю, когда при образовании раствора соблюдается аддитивность и при всех концентрациях
см3/моль, отвечает идеальному случаю, когда при образовании раствора соблюдается аддитивность и при всех концентрациях 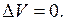 Как видно из рис. 6.2, сплавы Cd – Mg, за исключением области до
Как видно из рис. 6.2, сплавы Cd – Mg, за исключением области до  , образуются с уменьшением объема. Так для сплава
, образуются с уменьшением объема. Так для сплава 
 см3/моль. Для этого сплава парциальные молярные объемы, определяемые по отрезкам на осях координат, отсекаемых касательной (штриховая линия А), составляют
см3/моль. Для этого сплава парциальные молярные объемы, определяемые по отрезкам на осях координат, отсекаемых касательной (штриховая линия А), составляют 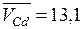 см3/моль и
см3/моль и  см3/моль. Объем всего сплава близок к 12,65 см3/моль. В соответствии с уравнением (6.12) он должен составить
см3/моль. Объем всего сплава близок к 12,65 см3/моль. В соответствии с уравнением (6.12) он должен составить  см3/моль.
см3/моль.
|
|
|

Рис. 6.2. – Молярные объемы жидких сплавов магния и кадмия
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 598; Нарушение авторских прав?; Мы поможем в написании вашей работы!