
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Давление пара растворенного вещества. Закон Генри. Закон Сивертса
|
|
|
|
Важным фактором, определяющим растворимость газов в жидкостях, является их парциальное давление. Согласно закону, найденному Генри опытным путем, при постоянной температуре количество растворенного газа в данном объеме растворителя пропорционально парциальному давлению газа.
Пусть идеальный газ при постоянной температуре находиться в соприкосновении с жидкостью, в которой он может растворяться. Условие равновесия распределения растворенного вещества между газом и жидкостью заключается в равенстве его химических потенциалов в этих фазах:
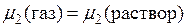
или
 ,
,
где 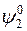 – величина, зависящая от температуры, имеющая смысл химического потенциала растворенного вещества при концентрации, равной единице, при условии, что раствор сохраняет свойства разбавленного. Так как величины
– величина, зависящая от температуры, имеющая смысл химического потенциала растворенного вещества при концентрации, равной единице, при условии, что раствор сохраняет свойства разбавленного. Так как величины 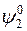 и
и 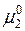 зависят только от температуры, то отношение
зависят только от температуры, то отношение 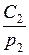 , являясь функцией температуры, при ее постоянстве также постоянно. Отношение обозначается буквой г, носящей название постоянной Генри. Таким образом, закон Генри имеет вид
, являясь функцией температуры, при ее постоянстве также постоянно. Отношение обозначается буквой г, носящей название постоянной Генри. Таким образом, закон Генри имеет вид
 и
и  . (6.12)
. (6.12)
Это уравнение позволяет рассматривать закон Генри, как описание зависимости парциального давления растворенного вещества над разбавленным раствором от его концентрации. Так как в разбавленном растворе все выражения для концентрации пропорциональны друг другу, то закон Генри справедлив при любом способе выражения концентрации.
Это уравнение справедливо, если вещество не меняет своей молекулярной массы при растворении. Например, при растворении азота в воде, в которой он существует в виде двухатомных молекул. Процесс растворения выражается уравнением
N2 (газ) = N2 (в водном растворе) и 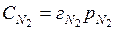 .
.
В металлах многоатомные газы, в том числе и азот, не растворяются в молекулярном состоянии, а находятся в растворе в виде атомов. Это объясняется тем, что при растворении необходимо раздвинуть частицы металла, весьма сильно взаимодействующие друг с другом. При растворении молекул газа с насыщенными внутренними связями между атомами металла затрата энергии не компенсируется выигрышем энергии вследствие взаимодействия между металлом и растворенным веществом. Такая компенсация в некоторой мере имеет место при растворении вещества в атомарном состоянии.
|
|
|
Растворение, например, азота в твердом или жидком железе сопровождается диссоциацией его молекул:
N2 (газ) = 2N (раствор в Fe)
В этом случае условие равновесия имеет вид
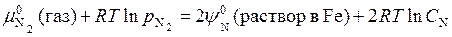 ,
,
откуда
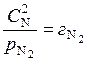 и
и 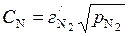 , (6.13)
, (6.13)
где
 .
.
Вообще растворимость двухатомных газов (N2, O2, H2 и т.п.) в металлах пропорциональна не их парциальному давлению, а корню квадратному из этой величины. Этот факт известен как закон Сивертса.
Растворение какого-либо газа А в конденсированной фазе можно рассматривать как реакцию
А (газ) = А (раствор),
константа равновесия которой 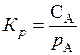 является величиной, равной константе Генри
является величиной, равной константе Генри  . Величина
. Величина  также называется коэффициентом растворимости, так как она численно равна растворимости при давлении равном 1 атм.
также называется коэффициентом растворимости, так как она численно равна растворимости при давлении равном 1 атм.
Константа Генри должна зависеть от температуры по тому же закону, как и константа равновесия:
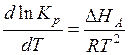 и
и 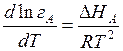 , (6.14)
, (6.14)
где  – изменение теплосодержания при растворении.
– изменение теплосодержания при растворении.
Растворение газов в обычных жидкостях сопровождается выделением тепла, которое по природе аналогично теплоте конденсации и  < 0. Таким образом, в этом случае
< 0. Таким образом, в этом случае  с температурой падает и, следовательно, при данном давлении растворимость уменьшается.
с температурой падает и, следовательно, при данном давлении растворимость уменьшается.
При растворении газов в металлах обычно тепло затрачивается на диссоциацию молекул и на раздвижение атомов металла, что не компенсируется энергией растворения. Вследствие этого растворимость газов в металлах, как правило, увеличивается с ростом температуры.
|
|
|
Интересно отметить, что растворимость азота в ά-Fe увеличивается с ростом температуры, а в γ-Fe, наоборот, уменьшается. В некоторых случаях энергия взаимодействия атомов газа и металла столь велика, что превышает затраты на диссоциацию и раздвижение атомов металла. Поэтому при растворении газа в металле происходит выделение тепла и растворимость уменьшается с ростом температуры. Это имеет место, например, при растворении водорода в титане.
Как отмечалось, для разбавленных растворов все выражения концентраций пропорциональны друг другу, поэтому закон Генри справедлив при любом способе выражения концентрации. Растворимость азота и водорода (в процентах по массе) в жидком железе при 1600 ºС определяются уравнениями:
 и
и 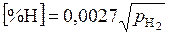 ,
,
где парциальные давления выражены в атмосферах.
Для практики существенно, что растворимость этих газов в жидком железе значительно выше, чем в твердом, и поэтому при кристаллизации жидкой стали могут возникать дефекты из-за присутствия газовых пузырей. Растворимость газов в металлах заметно зависит от концентрации других элементов. Так, присутствие углерода уменьшает растворимость азота в жидком железе, а ванадий значительно увеличивает ее. Это явление называется высаливанием и объясняется тем, что вблизи ионов свойства растворителя изменяются, уменьшается его способность растворять другие вещества.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 3842; Нарушение авторских прав?; Мы поможем в написании вашей работы!