
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория мономолекулярной адсорбции Ленгмюра
Теории мономолекулярной и полимолекулярной адсорбции газов и паров твердой поверхностью. Особенности адсорбции ионов на твердых поверхностях. Образование двойного электрического слоя. Методы получения и очистки коллоидных систем. Молекулярно-кинетические и оптические свойства коллоидных систем.
ЛЕКЦИЯ 13
В 1915 году И. Ленгмюр предложил теорию мономолекулярной адсорбции. Уравнение изотермы адсорбции Ленгмюра справедливо для широкого интервала концентраций и для границ раздела ж–г, ж–ж, т–г, т–ж.
Теория Ленгмюра базируется на следующих положениях:
1). Основное положение теории Лэнгмюра: поверхность адсорбента ограничена. Адсорбция вещества происходит не на всей поверхности, а только на активных центрах. Такими центрами могут служить отдельные атомы или группы атомов, выступающих над поверхностью адсорбента.
2). Каждый активный центр удерживает только одну молекулу.
3). Когда все активные центры заняты и поверхность адсорбента покрыта слоем толщиной в одну молекулу (мономолекулярный слой), наступает адсорбционное равновесие и дальнейшее увеличение адсорбции невозможно.
4). Процесс адсорбции имеет динамический характер. При равновесии скорость адсорбции и десорбции одинакова. Адсорбированные молекулы остаются некоторое время связанными с активными центрами, а затем покидают поверхность (десорбируются) и их место занимают другие молекулы Время пребывания молекулы на активном центре зависит от температуры.
5). Адсорбированные на активных центрах молекулы не взаимодействуют друг с другом.
Уравнение изотермы мономолекулярной адсорбции Ленгмюра имеет вид:
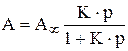 , (1)
, (1)
где А и А¥ ‑ соответственно величина адсорбции газа или пара при данном и предельном заполнении монослоя; К – константа адсорбционного равновесия 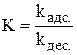 , р – равновесное давление газа или пара.
, р – равновесное давление газа или пара.
Это уравнение характеризует интенсивность взаимодействия адсорбента и адсорбата.
Для адсорбции веществ из растворов справедливо уравнение
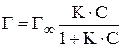 , (2)
, (2)
где Г – Гиббсовская адсорбция при концентрации С; Г¥ – максимальная или предельная адсорбция, соответствующая образованию монослоя, С – равновесная концентрация вещества в растворе.
Зависимость величины адсорбции от концентрации представлена на следующем рисунке
 |
Для экспериментальной проверки применимости уравнения Ленгмюра и нахождения постоянных Г¥ и К, уравнение Ленгмюра преобразовывают следующим образом. Делим единицу на левую и правую части уравнений (1), (2), получим:
 , (3)
, (3)
В координатах С / Г — С получаем прямую, и из графика находим величины Г ¥ и К (рис. 1). Зная опытное значение Г ¥, можно рассчитать площадь поперечного сечения молекулы и ее длину.
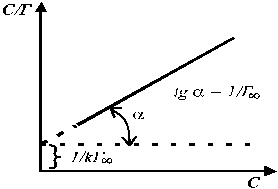
Рис. 1. Графическое определение постоянных Г ¥ и К в уравнении Ленгмюра.
Пример 13.1. При изучении адсорбции стеариновой кислоты С17Н35СООН на поверхности водного раствора найдено, что максимальная величина адсорбции Г ¥ = 7,465·10-10 моль/см2. Плотность кислоты 850 кг/м3. Найти площадь поперечного сечения молекулы S и длину молекулы l.
Решение. Все поверхностные молекулы воды характеризуются ненасыщенными межмолекулярными водородными связями, т. е. можно считать, что они являются активными центрами. Если на каждом активном центре адсорбируется одна молекула кислоты, то в пределе поверхность воды сплошь покрыта молекулами кислоты, причем полярная группа молекулы –СООН втягивается в воду, а неполярный радикал -С17Н35 выталкивается из воды в воздух, образуя «частокол».
Площадь, занимаемая одним молем кислоты при образовании мономолекулярного слоя, есть величина, обратная Г ¥:
 см2/моль.
см2/моль.
Тогда площадь, занимаемая одной молекулой, или же площадь поперечного сечения молекулы
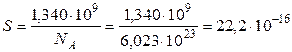 см
см =
=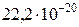 м2,
м2,
где N A – число Авогадро.
Объем одного моля кислоты равен отношению молярной массы к плотности
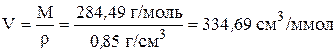 .
.
Если молекулы кислоты расположены в виде монослоя, то высота монослоя или же длина молекулы определяется из соотношения
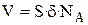 .
.
Отсюда

 .
.
Следует отметить, что впервые в истории химии размеры молекулы были определены на основании уравнений Гиббса и Ленгмюра, а впоследствии подтверждены и другими методами.
|
|
Дата добавления: 2013-12-13; Просмотров: 3024; Нарушение авторских прав?; Мы поможем в написании вашей работы!