
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы. Основные количественные характеристики растворов
Жидким раствором называется молекулярная смесь двух или нескольких веществ, находящихся в жидком состоянии. Вещество, присутствующее в растворе в большем количестве, называют растворителем, а другое – растворённым веществом.
Растворы, состоящие из двух веществ (компонентов), называют бинарными.
Количество веществ в растворе характеризуют концентрацией. Различают молярную и массовую концентрацию. Молярную концентрацию определяют как отношение количества молей молекул растворённого вещества ν2 (или количество молей растворителя ν1 ) к полному количеству молей молекул раствора:
 или
или 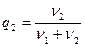 (6.51)
(6.51)
Причём 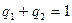 .
.
Гораздо удобнее использовать массовую концентрацию, поскольку компоненты легко взвесить,:
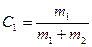 или
или 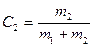 (6.52)
(6.52)
Причём  .
.
Как правило, жидкости можно смешивать в любых количествах. Твёрдые же вещества, добавленные в растворитель в большом количестве, не всегда полностью растворяются. Поэтому важной характеристикой растворов является растворимость. Под растворимостью понимают максимальную равновесную концентрацию растворяемого твёрдого вещества, то есть максимальную концентрацию, при которой твёрдое вещество, подлежащее растворению, находится в равновесии с раствором, то есть концентрацию насыщенного раствора.
Способность твёрдых веществ растворяться в том или ином растворителе зависит от давления и температуры.
Механизм растворения сводится к разрыву связей между молекулами каждого из исходных веществ и образованию новых связей между молекулами веществ, находящихся в растворе. Во многих случаях при растворении молекулы вещества распадаются на составные части – ионы (у солей, щелочей, кислот). Обычно на разъединение молекул при растворении вещества затрачивается определённая энергия, поэтому при растворении происходит охлаждение вещества. Энергию, затраченную на растворение, называют теплотой растворения.
После разъединения молекул растворяемого вещества силы притяжения между молекулами растворённого вещества и растворителя могут быть значительными, что приводит к образованию комплексов молекул. При этом за счёт работы сил притяжения внутренняя энергия увеличивается и происходит нагревание. Если увеличение внутренней энергии при образовании комплексов превышает уменьшение внутренней энергии за счёт разъединения молекул растворённого вещества, то итог процесса растворения сводится к нагреванию при растворении. Выделяющуюся при этом теплоту также называют теплотой растворения.
Растворы, у которых теплота растворения равна нулю, называют идеальными растворами. Это означает, что взаимодействие между молекулами растворённого вещества и растворителя такое же, как и между молекулами растворителя. Идеальными можно считать и любые растворы с малой концентрацией растворённого вещества.
|
|
Дата добавления: 2014-01-04; Просмотров: 1228; Нарушение авторских прав?; Мы поможем в написании вашей работы!