
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 25. Общие свойства растворов неэлектролитов
|
|
|
|
25.1 Осмотическое давление.
25.2 Давление пара над раствором. Закон Рауля.
25.3 Температура замерзания и кипения разбавленных растворов (следствия из закона Рауля).
25.1 Осмотическое давление.
Все растворы, т. е. многокомпонентные гомогенные системы, обладают некоторыми свойствами, которые зависят практически только от соотношения числа частиц компонентов раствора и не зависят от природы растворённых частиц. Они также называются коллигативными (коллективными). Точно так же, как общие свойства газов есть свойства идеального газа, а общие свойства кристаллов – это свойства идеального кристалла, общие свойства растворов – это свойства идеального раствора (см. лекцию 24).
Все растворы независимо от агрегатного состояния обладают способностью к диффузии. Диффузией называется свойство вещества равномерно распределяться по всему предоставленному ему объёму. Скорость диффузии, т. е. скорость выравнивания концентрации по объёму, в газах велика. Например, если осторожно пипеткой накапать немного брома в большую 2-3-литровую колбу, несмотря на то, что пары брома в 5,5 раз тяжелее воздуха, через несколько часов колба будет равномерно заполнена парами брома. В твёрдых телах при обычных температурах диффузия длится годами, в жидкостях диффузия растворимого вещества протекает за десятки часов, разумеется для небольших, порядка одного литра объёмов растворов.
Рис. 5.2. Схема осмоса через полупроницаемую мембрану:
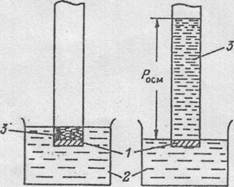 а – начальное состояние системы; б – конечное
а – начальное состояние системы; б – конечное
Если в сосуд налить концентрированный раствор, а поверх него чистый растворитель, то диффузия будет протекать в обоих направлениях – растворённое вещество будет диффундировать в растворитель, а растворитель – в раствор. В конце концов концентрация выравнивается по всему объёму.
|
|
|
Можно создать условия, при которых диффузия идёт только в одном направлении. Разделим раствор и растворитель плёнкой, через которую проходят молекулы растворителя, но не проходят молекулы (или в общем случае – частицы) растворённого вещества. Такая плёнка называется полупроницаемой перегородкой. В этом случае возможна только диффузия растворителя в раствор.
Процесс односторонней диффузии растворителя через полупроницаемую перегородку называется осмосом.
Если на конце стеклянной трубки сделать такую перегородку, обернув трубку, например, целлофаном и опустить её в воду (рис.5.2), налить внутрь трубки какой-нибудь раствор, например, сахара, то вследствие осмоса вода начнёт диффундировать в раствор. Для того, чтобы получилась полностью гомогенная система, вся вода должна перейти в раствор. Однако по мере диффузии воды объём раствора возрастает и давление на перегородку со стороны раствора увеличивается. Таким образом, возникает сила – гидростатическое давление, - препятствующая диффузии растворителя, и при некотором давлении наступает равновесие: сколько молекул воды переходит в раствор, столько же выталкивается обратно увеличившимся давлением.
Равновесное давление раствора, препятствующее диффузии растворителя через перегородку, называется осмотическим давлением.
Вант-Гофф показал, что для разбавленных растворов неэлектролитов независимо от природы растворённого вещества и растворителя
Росм = СRT, (5.4)
где Росм – осмотическое давление КПа; С – молярная концентрация раствора моль/л; Т – абсолютная температура; R – универсальная газовая постоянная. (Если давление измерено в Па. то формула примет вид
Росм = 1000 СRT. (5.4а)
Полная аналогия этого уравнения с уравнением состояния идеального газа позволило Вант-Гоффу сформулировать закон:
|
|
|
осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворённое вещество, если бы при данной температуре оно в виде газа занимало объём раствора (PV = nRT; P = 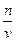 RT = CRT).
RT = CRT).
Осмотическое давление раствора очень велико, при нормальных условиях для раствора концентрацией 1 моль/л оно в 22,4 раза больше атмосферного.
Явления осмоса играют очень важную роль в жизни животных и растительных организмов. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непроницаемые для веществ, растворённых во внутриклеточной жидкости. Проникая в клетки, вода создаёт в них избыточное давление, которое слегка растягивает оболочки клеток и поддерживает их в напряжённом состоянии. Вот почему такие мягкие органы растения, как травянистые стебли, листья, лепестки цветов, обладают упругостью. Если срезать растение, то вследствие испарения воды объём внутриклеточной жидкости уменьшается, оболочки клеток опадают, становятся дряблыми – растение вянет. Но стоит только начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
Осмос является также одной из причин, обусловливающих поднятие воды по стеблю растения, питание клеток и многие другие явления.
25.2. Давление пара над раствором. Закон Рауля.
Давление пара над жидкостью зависит от ее испаряемости и температуры. Это объясняют различием сил межмолекулярного взаимодействия в различных по природе жидкостях: чем больше эти силы, тем меньше испаряемость жидкости и тем ниже давление пара над ней. В растворах силы межмолекулярного взаимодействия принимают такое же участие в парообразовании, как и в чистых жидкостях. Вследствие чего молекулы растворителя удерживаются в растворе сильнее, чем в чистом растворителе, так как в растворе на них дополнительно действуют частицы растворенного вещества. Это влечет за собой ухудшение ее испаряемости, т.е. давление паров растворителя над раствором ниже, чем над чистым растворителем.
Впервые это явление было обнаружено французским ученым Ф.М. Раулем (1830 – 1901) при исследовании растворов нелетучих веществ; он установил (1884 г.):
|
|
|
что давление пара над раствором нелетучего вещества пропорционально мол. доле растворителя в растворе (закон Рауля).
Так как в указанных условиях над раствором имеются только пары растворителя (растворенное вещество нелетуче), то
Р1 = Роi χi (5.5)
где Р1 и Роi - давление паров растворителя над раствором и над чистым растворителем; χi – мол. доля растворителя в растворе.
Воспользовавшись тем, что сумма мол. долей компонентов раствора равна единице (χ1 + χ2 = 1) и произведя преобразования в (5.5), получаем
Р1 = Р 01 (1 - χ2) = Р 0i - Роi χ2 ; Р 0i – Рi = Δ Р = Роi χ2 (5.5а)
где χ2 – мол. доля растворенного вещества в растворе.
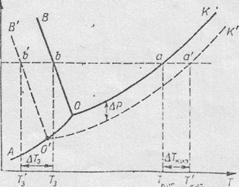 |
Рис. 5.3. Изменение фазовой диаграммы воды при раствореиии в ней нелетучего вещества.
Отсюда следует, что понижения давления пара над жидкостью при растворении в ней нелетучего вещества пропорционально мол. доле его в растворе. Разделив обе части
последнего выражения на Ро1, получим: (Роi – Рi)/ Роi = Δ Рi/ Ро1 = χ 2 (5.5б)
Левая часть (5.5б) – это относительное понижение давления пара над жидкостью при растворении в ней нелетучего вещества; его называют депрессией раствора. Таким образом, депрессия раствора равна мол. доле нелетучего компонента в нем.
Изменения, происходящие с жидкостью при растворении в ней нелетучего вещества, отражаются и на ее фазовой диаграмме. Действительно, графики зависимостей температур фазовых переходов от давления смещаются на Δ Р = ƒ (χ 2) (рис. 5. 3, штриховые линии). Кривая начала кипения раствора О К ровно на Δ Р ниже кривой кипения чистого растворителя ОК. Смещается, соответственно, и тройная точка диаграммы О, и кривая начала кристаллизации раствора О В. Неизменной остается лишь кривая сублимации, так как в кристаллическом состоянии система является гетерогенной и каждый ее компонент ведет себя независимо от другого. При затвердевании водных растворов отделяющаяся от раствора твердая фаза представляет почти чистый лед. Таким образом, на давление паров твердой фазы не влияет наличие растворённого вещества.
|
|
|
25.3. Температура замерзания и кипения разбавленных растворов.
Жидкость закипает тогда, когда давление пара над ней выравнивается с внешним давлением. Так при давлении P чистый растворитель закипит при T кип, что соответствует состоянию системы, изображенному точкой а. Раствор же при таком внешнем давлении закипит при T кип, соответствующей состоянию системы в точке а, т.к. только в ней давление насыщенного пара и внешнее давление становятся равным (см. рисунок).
Аналогично замерзание (кристаллизация) чистого растворителя происходит при Т3, соответствующей состоянию системы в точке b, т.к. в ней давление насыщенного пара и внешнее давление выравниваются. Для раствора такое состояние соответствует точке b. Следовательно, при внешнем давлении P кристаллизация растворителя из раствора начнется при T3 . Таким образом, при P внешн = const раствор закипает при более высокой температуре, чем чистый растворитель, а начинает замерзать при более низкой.
Из рисунка следует, что изменение температур фазовых переходов
∆T3 и ∆T кип. соответствуют понижению давления пара над жидкостью ∆P при растворении в ней нелетучего вещества.
А так как ∆P пропорционально мол. доле растворенного вещества, то и изменение температур фазовых переходов пропорциональны концентрации раствора.
В 1882 г. Рауль установил –
повышение температуры начала кипения ∆Tкип и понижение температуры начала кристаллизации ∆T3 жидкости пропорционально моляльности раствора, полученного при растворении в ней нелетучего вещества.
∆Tкип = К эб Сm (5.6)
∆Tзам = К к C m (5.7)
Коэффициент пропорциональности К н называют криоскопической постоянной. Он характеризует понижение температуры начала замерзания растворителя при растворении в 1кг его 1 моль нелетучего вещества (моляльный коэффициент понижения температурызамерзания).
Коэффициент пропорциональности К эб называют эбулиоскопической постоянной.
Он характеризует повышение температуры начала кипения растворителя при растворении в 1 кг его 1 моль нелетучего вещества (моляльный коэффициент повышения температуры кипения).
Криоскопическая и эбулиоскопическая постоянные зависят только от природы растворителя. Обычно их значения определяют экспериментально.
Для растворов электролитов рассмотренные свойства будут уточнены после изучения растворов электролитов (лекция 26).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 839; Нарушение авторских прав?; Мы поможем в написании вашей работы!