
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условие это выполняется или при сокращении площади поверхности тела
|
|
|
|
НЕСТЕРОИДНЫЕ АНАБОЛИКИ
КАЛИЯ ОРОТАТ
Оротовая кислота является предшественником нуклеотидов, которые необходимы для синтеза нуклеиновых кислот и, соответственно, белка.
Форма выпуска таблетки 0,5г.
Применяют по 1 таблетки 3-4 раза в день, курс лечения 3-5 недель при нарушениях белкового обмена (заболеваниях печени, дистрофии миокарда, аритмиях, физических перегрузках и т. п.).
Не применяется как источник калия.
Как средства, стимулирующие метаболизм, могут быть применены: АТФ, ФОСФАДЕН таблетки, РИБОКСИН, КАРНИТИНА ХЛОРИД, МЕТИЛУРАЦИЛ
(∆S < 0) или при уменьшении его удельной поверхностной энергии (∆ σ < 0).
Стремление тел к сокращению площади поверхности рассмотрено ранее на примере жидкости, характеристикой этого стремления служит поверхностное натяжение. Рассмотрим процесс, ведущий к убыли σ.
На рис. 7.1 изображен элемент термодинамической системы вблизи поверхности раздела фаз: заштрихованный участок изображает твердое тело А, незаштрихованный – газ (жидкость). Частицы поверхности твердого тела, обладая избытком энергии, создают вблизи его поверхности некоторое энергетическое поле (поверхностную энергию). При появлении вблизи поверхности тела А инородных частиц Х часть избыточной энергии расходуется на “связывание “ этих частиц и поверхностная энергия тела А уменьшается. На участке взаимодействия поверхности с инородной частицей энергетическое поле поверхности ослабевает. В итоге вблизи поверхности тела накапливаются (концентрируются) инородные частицы и уменьшается поверхностная энергия.
Различные вещества по-разному влияют на поверхностную энергию тел. Это влияние обычно описывают производной dσ / dc, выражающей изменение удельной поверхностной энергии тела dσ в зависимости от приращения концентрации соответствующего вещества dс. В вышеописанном примере d σ /dc <0, т.е. удельная поверхностная энергия тела А уменьшалась под влиянием частиц вещества Х.
|
|
|
Процесс самопроизвольного концентрирования вещества на поверхности какого-либо тела называется адсорбцией ( поглощением). Так как любая поверхность раздела фаз обладает поверхностной энергией, адсорбция возможна на любой поверхности раздела фаз: между жидкостью и газом, между твер-
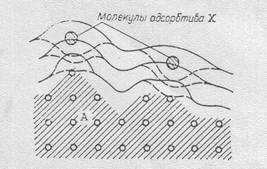 дым телом и газом, между двумя несмешивающимися жидкостями, между твердым телом и жидкостью. Тела, на поверхности которых происходит адсорбция, называются адсорбентами. Обычно – это твердое тело с развитой поверхностью. Например, у активного угля, используемого в качестве адсорбента, удельная поверхность достигает
дым телом и газом, между двумя несмешивающимися жидкостями, между твердым телом и жидкостью. Тела, на поверхности которых происходит адсорбция, называются адсорбентами. Обычно – это твердое тело с развитой поверхностью. Например, у активного угля, используемого в качестве адсорбента, удельная поверхность достигает
Рис.7.1.Влияние адсорбтива на 1000 м2 / г.
поверхностную энергию адсорбента. Адсорбирующиеся на поверхности ад-
Сплошные линии характеризуют сорбента вещества называют адсорб -
силовое поле поверхности адсорбен- тивом (иногда адсорбатом). Глубину
та до адсорбции, а штриховые после протекания адсорбции характеризуют
нее. удельной адсорбцией, которая опреде-
ляется как количество адсорбтива (в моль) адсорбировавшегося на поверхности адсорбента, площадью в 1м2
ГS = n/S, моль/м2. (7.3.)
где n – число моль адсорбтива, адсорбированного адсорбентом, площадь поверхности которого равна S м2.
Определение площади поверхности адсорбента – операция довольно трудоемкая, поэтому на практике удельную адсорбцию относят к 1 кг адсорбента.
Гm = n/m, моль/кг (7.3а.)
где n – число моль адсорбтива, адсорбированного m кг адсорбента.
В1876 г. Гиббс на основании второго закона термодинамики вывел уравнение (уравнение изотермы адсорбции Гиббса ), описывающее адсорбцию на однородной поверхности:
|
|
|
ГS = - 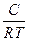
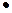
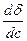
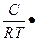 (7.4)
(7.4)
где с – равновесная концентрация адсорбтива в объеме фазы, граничащей с адсорбирующей поверхностью, моль/м3; ơ – коэффициент поверхностного натяжения (удельная поверхностная энергия адсорбента, Н/м).
Из уравнения изотермы адсорбции Гиббса следует, что в зависимости от закона производной dơ/ dc направление процесса адсорбции может быть различным. Если dσ/dc< 0, то ГS >0 и на поверхности адсорбента вещество концентрируется, т.е. адсорбция положительна (протекает адсорбция). Если же dσ/dc> 0, то ГS < 0 и вещество не только не адсорбируется а, более того, отделяется от поверхности тела. Это явление называют отрицательной адсорбцией, или десорбцией.
В зависимости от характера взаимодействия с поверхностью раздела фаз, вещества подразделяются на поверхностно-активные (ПАВ) и поверхностно-неактивные (ПНАВ) (см. лекц.5). Академик П.А. Ребиндер (1898-1972) предложил производной dσ / dc количественно оценивать поверхностную активность вещества:
А а = - dσ / dc (7.5.)
Если А а > 0, то рассматриваемое вещество поглощается поверхностью и является ПАВ, если же А а< 0, то рассматриваемое вещество “безразлично “ к поверхности адсорбента и является ПНВА. Чем больше А а, тем выше поверхностная активность вещества. ПАВ адсорбируются поверхностью адсорбента (жидкости), поэтому они приводят к уменьшению поверхностной энергии (поверхностного натяжения). ПНАВ не адсорбируются поверхностью адсорбента, поэтому они не уменьшают поверхностную энергию, а, напротив, приводят к ее увеличению, если А а < 0.
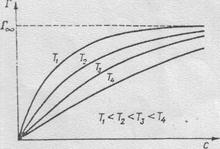
Уравнение Гиббса позволяет также определять и характер зависимости удельной адсорбции от температуры и равновесной концентрации адсорбтива в среде, окружающей адсорбент. Согласно уравнению Гиббса, удельная адсорбция обратно пропорциональна абсолютной температуре системы. Гораздо сложнее выглядит зависимость удельной адсорбции от равновесной концентрации адсорбтива. На рис.7.2 приведены изотермы адсорбции, т.е. зависимости удельной адсорбции от равновесной концентрации адсорбтива при Т = const. Для сравнения приведены изотермы, соответствующие температурам Т1 < T2 < T3 < T4. Ход кривых показывает, что при любой температуре Г увеличивается с ростом с и стремится к общему пределу Г∞. Расположение изотерм указывает на зависимость удельной адсорбции от температуры: чем она выше, тем мень-
|
|
|
 ше Г. Большой поверхностной (адсорбционной способностью) обладают карбоновые кислоты и их соли. Объясняется это их дифильностью – одновременным сродством к растворителям полярного и неполярного типов. Наличие в молекулах ионов водорода или металла
ше Г. Большой поверхностной (адсорбционной способностью) обладают карбоновые кислоты и их соли. Объясняется это их дифильностью – одновременным сродством к растворителям полярного и неполярного типов. Наличие в молекулах ионов водорода или металла
Рис.7.2. Изотермы адсорбции сообщает им сродство к полярной среде
Лэнгмюра. (вода, спирты и т.п.), а наличие развитого
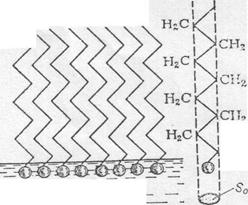
углеводородного радикала сообщает сродство к неполярной среде (углеводороды, воздух и т. п.). В связи с этим молекулы карбоновых кислот и их солей скапливаются на поверхности раздела фаз, ориентируясь полярной частью к полярной среде, а неполярной – к неполярной (рис.7.3.)
 Поверхностная активность карбоновых кислот и их солей зависит от длины углеводородной цепи молекулы. Согласно эмпирическому правилу Дюкло – Траубе увеличение углеводородной части молекулы карбоновой кислоты на одно звено -СН2 - повышает поверхностную активность вещества приблизительно в 3,2 раза.
Поверхностная активность карбоновых кислот и их солей зависит от длины углеводородной цепи молекулы. Согласно эмпирическому правилу Дюкло – Траубе увеличение углеводородной части молекулы карбоновой кислоты на одно звено -СН2 - повышает поверхностную активность вещества приблизительно в 3,2 раза.
Следовательно, карбоновые кислоты и их соли способны образовать на поверхности раздела “полярная среда – неполярная среда“ мономоле-кулярные пленки. На этом свойстве основана технология изготовления осветляющих покрытий оптических стекол. Древнегреческие мореплаватели использовали это свойство для
“усмирения “ волн во время шторма: Рис. 7.3. Схема мономолекулярной
оливковое масло, выливаемое в море: адсорбции карбоновых кислот.
как жертвоприношение Посейдону,
покрывало поверхность воды тонким слоем и предотвращало образование опасных гребней на волнах.
Экспериментальное изучение адсорбции на поверхности жидкости позволило американскому физико-химику И. Лэнгмюру (1881-1975), основываясь на кинетической теории строения вещества, вывести в 1919 г. простое уравнение изотермы адсорбции – уравнение Лэнгмюра

Г = Г ∞ 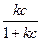 (7.6.)
(7.6.)
где Г ∞ – максимальная удельная адсорбция; k – постоянная, характеризующая систему при данной температуре.
|
|
|
На рис. 7.2. показан характер зависимости Г = f (с), согласующийся с уравнением изотермы адсорбции Лэнгмюра. При концентрациях адсорбтива с→ 0 зависимость Г = f(с) линейна: Г ≈ Г ∞ kс ≈ Кс (Г ∞ - const; произведение двух констант – константа). При (с → ∞) удельная адсорбция стремится к предельному значению: Г→ Г ∞
Найдено, что при достаточно низких температурах Г∞ = const в пределах одного гомологического ряда, к которому принадлежит рассматриваемый адсорбтив. Это объясняется тем, что при насыщении поверхности адсорбента молекулы адсорбтива расположены на поверхности строго перпендикулярно ей (см. рис.7.3.)
Необходимо, однако, отметить, что уравнение изотермы адсорбции Лэнгмюра и выводы из него справедливы лишь для случая мономолекулярной адсорбции, т.е. для низких концентраций адсорбтива и достаточно высокой температуры.
Найдено, что при высоких концентрациях адсорбтива, особенно при низких температурах (ниже критической), он поглощается поверхностью адсорбента в несколько слоев. Это явление называется полимолекулярной адсорбцией (рис.7.4.)
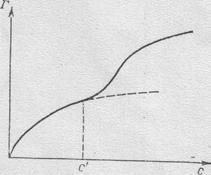 Из формы изотермы (см. рис. 7.4.) следует, что при низких концентрациях (до с) адсорбция мономолекулярная и лишь при высоких концентрациях начинают образовываться второй и третий слои. Глубина полимолекулярной адсорбции и ее механизм не одинаковы для различных веществ. Имеются сведения о специфичности
Из формы изотермы (см. рис. 7.4.) следует, что при низких концентрациях (до с) адсорбция мономолекулярная и лишь при высоких концентрациях начинают образовываться второй и третий слои. Глубина полимолекулярной адсорбции и ее механизм не одинаковы для различных веществ. Имеются сведения о специфичности
полимолекулярной адсорбции и ее отличии от мономолекулярной адсорбции во всем
Рис.7.4. Типичная изотерма поли- интервале изменений концентрации от 0 до молекулярной адсорбции. ∞.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 440; Нарушение авторских прав?; Мы поможем в написании вашей работы!