
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчёты в титриметрическом анализе
|
|
|
|
I. Способы выражения концентраций в титриметрическом анализе.
В титриметрическом анализе используют следующие основные способы выражения концентраций растворов.
1) Молярная концентрация c(A) - количество растворенного вещества А в молях, содержащееся в одном литре расвора:

где n(А) — количество растворенного вещества А, моль; V(A) — объем раствора, л; m(A) — масса растворенного вещества А, г; М(А) — молярная масса растворенного вещества А, г/моль. Молярная концентрация измеряется в моль/л.
2) Молярная концентрация эквивалента c (1/zA), или нормальность (старое название) - количество растворенного вещества А в молях, соответствующее эквиваленту вещества А, содержащееся в одном литре раствора:
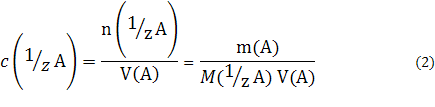
где 1/z — фактор эквивалентности; рассчитывается для каждого вещества на основании стехиометрии реакции, n(1/zA) — количество вещества, равное эквиваленту А в растворе, моль; M(1/zA) — молярная масса эквивалента растворенного вещества А, г/моль.
Молярная концентрация эквивалента измеряется в моль/л.
3) Титр Т(А) растворенного вещества А — это масса растворенного вещества А, содержащаяся в одном миллилитре раствора:
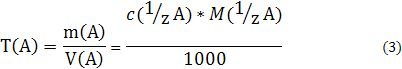
где объем раствора V(A) измеряется в мл.
Титр измеряется в г/мл; в некоторых случаях — в мкг/мл. Иногда титр обозначают символом t (А).
4) Титр раствора по определяемому веществу X, или Титриметрический фактор пересчета t (T\X) - масса титруемого вещества X, взаимодействующая с одним миллилитром титранта Т:
Обозначаем t (Т/Х)
Вывод формулы для t (Т/Х)
Пусть при титровании протекает реакция:
X + T = продукты реакции
Согласно закону эквивалентов вещества X и T реагируют в эквивалентных количествах
|
|
|
n(1/zx)=n(1/zT)
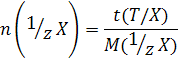
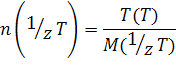
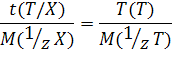
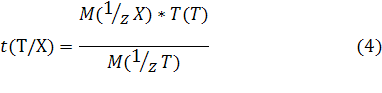
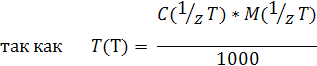
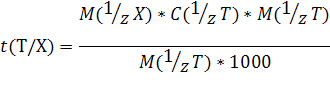
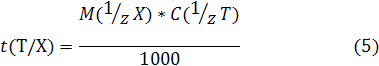
Измеряется, как и титр раствора, в г/мл.
Титр по определяемому веществу используется при расчете массы определяемого компонента по результатам титриметрического анализа лекарственных препаратов и других веществ.
Пусть, например, на титрование анализируемого раствора, содержащего определяемый компонент X, израсходован объем титранта V(T) мл с молярной концентрацией эквивалента c (1/zТ).
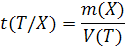
Согласно определению
m(X)=t(T/X)*V(T)
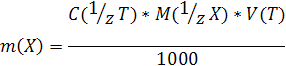
5) Поправочный коэффициент F(или K) - число, выражающее отношение действительной (практической) концентрации c (1/zA)пр. вещества А в растворе к его заданной (теоретической) концентрации c (1/zA)теор.:
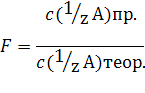
Пусть, например, требуется приготовить раствор с заданной (теоретической) концентрацией 0,1000 моль/л. Практически приготовлен раствор с близкой (но не точно равной 0,1000 моль/л) концентрацией 0,1056 моль/л. Тогда поправочный коэффициент равен
F = 0,1056/0,1000 = 1,056
В дальнейшем при применении приготовленного раствора можно во всех расчетах использовать теоретическую концентрацию, вводя поправочный (для данного раствора) коэффициент, что упрощает проведение расчетов.
Отечественная Государственная Фармация рекомендует готовить стандартные растворы с поправочным коэффициентом в пределах 0,98—1,02.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 11715; Нарушение авторских прав?; Мы поможем в написании вашей работы!