
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Индикаторы окислительно-восстановительного титрования
|
|
|
|
Классификация индикаторов ОВ титрования. В титриметрических редокс-методах определяют КТТ индикаторным методом. При этом роль индикатора может играть либо сам реагент, участвующий в OB реакции либо специально вводимый индикатор. В соответствии с этим индикаторы, применяемые в редоксметрии, можно классифицировать следующим образом.
1) Индикатор – реагент, участвующий в ОВ реакции. Примером может служить раствор титранта - перманганата калия КМnО4 в перманганатометрии. Раствор перманганата калия обладает интенсивной малиново-фиолетовой окраской, поэтому первая же капля избыточного титранта после ТЭ окрашивает титруемый раствор в розово-малиновый цвет. Титрование оканчивают при появлении устойчивой розово-малиновой окраски раствора.
2) Индикатор – вещество, вступающее в специфическое взаимодействие с окислителем или восстановителем (участвующим в ОВ реакции) с образованием окрашенных соединений.
Примером может служить свежеприготовленный раствор крахмала, который в присутствии иода окрашивается в синий цвет.
Другой пример - тиоцианат-ионы NCS-. используемые в качестве индикатора при титровании железа (III), с которым они образуют комплексы, окрашенные в интенсивно-красный цвет. Так, при титровании железа (III) титрантом, содержащим титан (III), протекает реакция
Fe3+ + Ti3+ = Fe2+ + Ti4+
3) Индикатор – вещество, которое при определенном потенциале раствора окисляется или восстанавливается с изменением окраски. Такие индикаторы называют редокс-индикаторами, или окислительно-восстановительными индикаторами другими словами, редокс-индикаторы - это индикаторы, способные окисляться или восстанавливаться с изменением окраски в ТЭ или вблизи ее.
|
|
|
Окислительно-восстановительные индикаторы бывают обратимыми и необратимыми. Обратимые индикаторы меняют окраску обратимо при потенциале раствора в ТЭ или вблизи ее и при этом не разрушаются. Необратимые индикаторы изменяют окраску при достижении определенного значения потенциала в ТЭ или вблизи её и при этом необратимо разрушаются.
Обратимые редокс-индикаторы. Окисленная и восстановленная
формы индикатора имеют различную окраску. Изменение цвета индикатора происходит при определенном значении потенциала раствора.
Полуреакцию, соответствующую изменению окраски редокс-индикатора можно представить в виде
Ihdox + ne = Indred
где Ihdox и Indred - соответственно окисленная и восстановленная формы индикатора.
ОВ потенциал Е редокс-пары Ihdox|Indred описывается уравнением Нернста, которое для комнатной температуры можно представить в виде
Е = Е0 + (0,059/n)lg([Ihdox]/[ Indred]),
где Е0 – стандартный ОВ потенциал данной редокс-пары.
Как и для кислотно-основных индикаторов, полагают что при примерно одинаковой интенсивности окраски обеих форм индикатора глаз человека воспринимает окраску раствора той формы индикатора, концентрация которой в 10 раз больше концентрации другой формы того же индикатора, то есть если
[Indox]
 =10
=10
[IndHd]
то раствор принимает окраску окисленной формы. Если
[Indox] 1

 =
=
[IndHd] 10
то окраске окисленной формы индикатора соответствует потенциал

а окраске восстановленной формы – потенциал
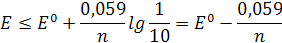
Объединяя оба эти выражения, получаем для интервала изменения окраски (интервала перехода)
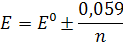
Получаем для изменения окраски редокс-индикатора (интервала перехода) приближенно:
Е = Е0 ± 0,059/n
т.е. окраска индикатора изменяется в пределах измерения потенциала раствора от Е0 + 0,059/n В до Е0 - 0,059/n В.
Примеры обратимых индикаторов:
| Индикатор | Е0, В | Цвет формы индикатора | |
| окисленная | восстановленная | ||
| Дифениламин | 0,76 | сине-фиолетовый | бесцветный |
| N-фенилантраниловая к-та | 1,00 | фиолетовый | » |
| Ферроин | 1,06 | бледно-голубой | красный |
|
|
|
Одним из первых предложенных обратимых редокс-индикаторов является дифениламин C6H5-NH-C6H5. Полагают, что в присутствии окислителей дифениламин претерпевает в растворе превращения в соответствии с полуреакцией
2C6H5-NH-C6H5 → C6H5-NH-C6H4- C6H4-NH-C6H5 + 2Н+ + 2ē
дифениламин бесцветный дифенилбензидин бесцветный
Затем дифенилбензидин окисляется с образованием фиолетовой формы индикатора
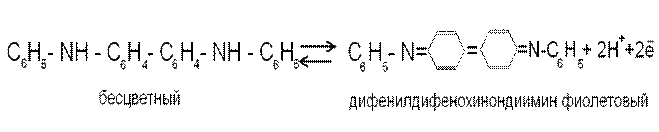
Интервал перехода окраски E = 0,76 ± 0,0295
К недостаткам дифениламина как редокс-индикатора относится его малая растворимость в воде (обычно готовят его 1%-ный раствор в концентрированной серной кислоте).
В качестве редокс-индикатора применяют также N-фенилантраниловую кислоту (2-дифениламинкарбоновую кислоту):
СООН
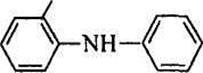
окисленная форма которой имеет фиолетово-красную окраску. Интервал (потенциал) перехода составляет Е = 1,00 ± 0,059 В. В отличие от дифениламина N-фенилантраниловая кислота растворяется в воде, поэтому обычно готовят ее 0,2%-ный водный раствор или же 0,1%-ный раствор в 0,2%-ном растворе соды.
Индикатор ферроин представляет собой комплекс железа(II) с ортофенантролином состава [FeL3]2+, где L - молекула ортофенантролина (1,10-фенантролина)
Ферроин обратимо претерпевает окислительно-восстановительное превращение.
[FeL3]3+ + e = [FeL3]2+
окисленная форма восстановленная форма
(бледно-голубая) (красная)
Интервал (потенциал) перехода составляет Е = 1,06 В. Ферроин как редокс-индикатор обладает целым рядом достоинств: его растворы стабильны; окисленная форма индикатора устойчива по отношению к действию сильных окислителей; он проявляет резкое изменение окраски, которое осуществляется быстро и обратимо; допускает титрование при нагревании вплоть до ~60 °С.
Обычно раствор этого индикатора готовят, смешивая 1,624 г гидрохлорида фенантролина и 0,695 г FeSO4 ∙ 7Н2О в 100 мл воды.
Необратимые ОВ индикаторы. К индикаторам этой группы относятся:1) метиловый-оранжевый, 2) метиловый красный, 3)нейтральный красный. При потенциале раствора, равном потенциалу в ТЭ они необратимо окисляются, вследствие чего исчезает присущая им окраска раствора.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6789; Нарушение авторских прав?; Мы поможем в написании вашей работы!