
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые осадительного титрования
|
|
|
|
Способы (виды) проведения осадительного титрования.
Требования, предъявляемые к реакциям в методе осадительного титрования.
Реакции, применяемые в осадительном титровании, должны отвечать ряду требований, важнейшими из которых являются следующие.
1) Определяемое вещество должно хорошо растворяться в воде с образованием бесцветного раствора и содержать хотя бы один ион, вступающий в реакции осаждения.
2) Реакция осаждения должна протекать строго стехиометрически. Побочные реакции и процессы соосаждения титранта или определяемого вещества с образующимся осадком исключаются.
3) Реакция должна протекать практически до конца. Метод осадительного титрования целесообразно применять тогда, когда, например, для бинарного выпадающего осадка типа МА, включающего два иона — катион и анион, произведение растворимости K°s < 10-8, т.е. образуется малорастворимый осадок. В этом случае реакция протекает практически не менее чем на 99,99%.
4) Осадок должен выпадать быстро, при комнатной температуре, без образования пересыщенных растворов.
Классификация методов осадительного титрования.
Методы осадительного титрования обычно классифицируют по природе активного реагента, взаимодействующего с определяемыми веществами, следующим образом (в скобках указан реагент, используемый в качестве основного в данном методе: 1) аргентометрия (AgNO3); 2) тиоцианатометрия (KNCS или NH4NCS); 3) меркурометрия (Hg2(NO3)2); 4) гексацианоферратометрия (K4[Fe(CN)6]; 5) сульфатометрия (H2SO4); 6) бариметрия (BaCl2).
В осадительном титровании применяют: 1) прямое, 2) обратное титрование, а косвенное – нет.
Прямым аргентометрическим титрованием определяют, в частности, галогенид-ионы, титруя анализируемый раствор, содержащий эти ионы,
стандартным раствором титранта-осадителя AgNO3, например:
|
|
|
Ag+ + Cl- = AgCl↓
Способом обратного осадительного титрования можно определять бромид-ионы в бромиде калия. Для этого к анализируемому раствору, содержащему бромид-ионы, прибавляют точно известное количество стандартного раствора AgNO3 в избытке по сравнению со стехиометрическим количеством. Бромид-ионы осаждаются практически полностью:
KBr + AgNO3 = AgBr↓ + KNO3
X избыток
Остаток избыточного нитрата серебра, не вступившего в реакцию с бромид-ионами, оттитровывают стандартным раствором тиоцианата аммония:
AgNO3 + NH4NCS = AgNCS↓ + NH4NO3
остаток
Кривая осадительного титрования — графическое изображение изменения концентрации определяемого вещества (или титранта) в зависимости от объема прибавленного титранта (или определяемого вещества).
Часто кривые осадительного титрования строят в координатах рМ —V(Т) или рА — V(Т), где показатель концентрации катионов металла рМ = -lg[Мn+]; рА = -lg [An-]; V(Т) — объем прибавленного титранта.
Расчет и построение кривых осадительного титрования. Рассмотрим расчет и построение кривых осадительного титрования на примере аргентометрического титрования раствора хлорида натрия (Х) стандартным раствором нитрата серебра (Т):
NaCl + AgNO3 = AgCI↓ + NaNO3
X T
В качестве начальных условий выберем следующие: объем исходного анализируемого раствора: V(NaCl) = V(Х) = 100 мл = 0,1 л концентрация исходного анализируемого раствора: c(NaCl) = с(Х) = 0,1 моль/л; объем прибавленного титранта: V(AgNO3) = К(Т) - переменная величина; концентрация титранта: c(AgNO3) = с(Т) = 0,1 моль/л. Произведение растворимости хлорида серебра равно: Ks°(AgCI) = 1,78 • 10-10; -lg Ks°(AgCl) = pKs° = 9,75.
Для построения кривой осадительного титрования рассчитаем pCl =-lg [C1-] в различные моменты титрования, а также найдем pAg = = -lg [Ag+] = Ks°(AgCl) - pCl = 9,75 - pCl после начала прибавления титранта.
|
|
|
1) Расчет pCl для исходного анализируемого раствора. Очевидно, что для исходного анализируемого раствора:
pCl = -lg[Cl-] = -lg 0,1 = 1.
2) Расчет pCl до точки эквивалентности. После начала прибавления титранта и до ТЭ концентрация хлорид-ионов в титруемом растворе уменьшается. Без учета растворимости осадка можно записать:
[Cl-] = [c(X)V(X) – c(T)V(T)]/[V(X) + V(T)].

Зная объем прибавленного титранта и учитывая начальные условия, можно рассчитать [Сl-] и затем pCl = -lg [Сl-].
3) Расчет pCl в точке эквивалентности. В ТЭ теоретически все хлорид-ионы оттитрованы; образовалось эквивалентное количество хлорида серебра, который, хотя и незначительно, все же растворяется:
AgCl ↔ Ag+ + Cl-
осадок раствор
pCl = -lg[Сl-] = -lg Ks°(AgCl)/2 = рKs°(AgCl)/2 = 9,75/2 = 4,875.
4) Расчет pCl после точки эквивалентности. После ТЭ дальнейшее прибавление титранта — раствора нитрата серебра — приводит к уменьшению растворимости осадка AgCl за счет влияния избытка вводимых одноименных ионов — катионов серебра Ag+, входящих в состав осадка и титранта. Равновесная концентрация хлорид-ионов вследствие этого уменьшается. Значение pCl можно рассчитать, зная произведение растворимости хлорида серебра и равновесную концентрацию катионов серебра:
Ks°(AgCl) = [Ag+]  [Сl-],
[Сl-],
рKs°(AgCl) = pAg + pCl,
pCl = рKs°(AgCl) – pAg = 9,75 – pAg.
Равновесная концентрация катионов серебра и, следовательно, pAg определяются избытком прибавленного титранта (если пренебречь растворимостью осадка):
[Ag+] = [с(Т)V(T) - с(Х) V(Х)]/[V(X) + V(T)].
Кривая осадительного титрования имеет вид:
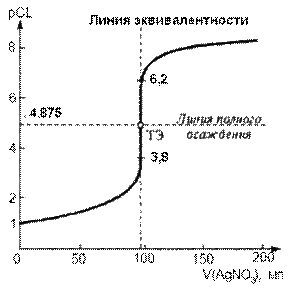
Рассчитанная кривая осадительного титрования 100 мл 0,1 моль/л раствора хлорида натрия стандартным 0,1 моль/л раствором нитрата серебра.
В рассматриваемом случае линии полного осаждения на рисунке соответствует значение pCl = 4,875 в ТЭ.
Скачок титрования рСl лежит в интервале примерно от pCl ≈ 3,8 до pCl ≈ 6,2. Поэтому при индикаторной фиксации КТТ следует использовать такой индикатор, который резко изменял бы свои видимые свойства в указанном интервале скачка на кривой титрования.
Аналогично рассчитываются и строятся кривые осадительного титрования и в других случаях.
Влияние различных факторов на скачок кривой осадительного титрования. Чем протяженнее скачок на кривой осадительного титрования,
тем больше имеется возможностей для подбора соответствующего индикатора. На величину скачка кривой осадительного титрования влияют: 1) концентрация растворов титруемого вещества и титранта; 2) растворимость образующегося при титровании осадка; 3) температура; 4) ионная сила раствора.
|
|
|
1) С понижением концентраций растворов определяемого вещества и титранта уменьшается протяженность скачка на кривой титрования.
2) Растворимость осадка, образующегося в процессе осадительного титрования, сильно влияет на протяженность скачка титрования. Чем ниже растворимость осадка (меньше его произведение растворимости), тем протяженнее скачок на кривой осадительного титрования.
3) Температура оказывает влияние на скачок титрования тогда, когда при варьировании температуры заметно изменяется растворимость осадка. В большинстве случаев растворимость осадка возрастает с увеличением температуры, поэтому осадительное титрование обычно проводят при температуре, не превышающей комнатную.
4) Изменение ионной силы раствора сравнительно мало сказывается на скачке титрования, поскольку влияние изменения ионной силы раствора на растворимость осадков относительно невелико по сравнению с действием других факторов, рассмотренных выше.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 12948; Нарушение авторских прав?; Мы поможем в написании вашей работы!