
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теорія електролітичної дисоціації
Сучасна теорія електролітичної дисоціації складалася на основі гіпотези Арреніуса про розщеплення молекул на йони, гідратної теорії Менделєєва, яка стверджувала, що розчинена речовина обов¢язково вступає у хімічну взаємодію з молекулами розчинника, і робіт Каблукова, присвячених сольватації йонів.
Теорія електролітичної дисоціації містить декілька положень.
1. Розчинення електроліту супроводжується його розкладанням на позитивно і негативно заряджені йони, які піддаються сольватації (або гідратації, якщо розчинником є вода). Щоб записати у загальному вигляді рівняння електролітичної дисоціації, яка відбувається у водному розчині, символами Kt і An позначають відповідно позитивно заряджений йон (катіон) і негативно заряджений йон (аніон), а індексами x і y – кількості йонів кожного знака. З урахуванням процесу гідратації, внаслідок якої утворюється гідрат катіона з n молекулами води і гідрат аніона с m молекулами води, повне рівняння електролітичної дисоціації записують так:
KtxAny + (xn + ym)H2O Û x[Kt(H2O)n]y+ + y[An(H2O)m]x–,
але частіше користуються спрощеним рівнянням дисоціації, не враховуючи процесу гідратації:
KtxAny Û xKty+ + yAnx–.
При цьому сумарний заряд аніонів за абсолютною величиною дорівнює сумарному заряду катіонів, тому електроліт в цілому електронейтральний. Наприклад, при дисоціації алюміній сульфату сумарний заряд аніонів дорівнює –6n, а сумарний заряд катіонів – +6n:
nAl2(SO4)3 à 2 nAl 3+ + 3 nSO4 2–.
Властивості йонів відрізняються від властивостей атомів, з яких вони утворилися. Сольватовані йони перебувають у стані невпорядкованого теплового руху і переміщуються у розчині за різними напрямками.
2. При пропусканні електричного струму через розчин чи розплав електроліту йони набувають напрямленого руху: позитивно заряджені переміщуються до катода (саме тому вони одержали назву катіон),а негативно заряджені – до анода, тому вони називаються аніон (рис. 6.4).
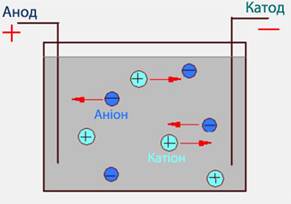
Рисунок 6.4 – Напрямок руху позитивно і негативно заряджених йонів в електричному полі
3. Електролітична іонізація є оборотним процесом, тобто одночасно з розпадом молекул на йони відбувається зворотний процес – сполучення йонів у молекули – асоціація, або рекомбінація.
4. Електрична провідність розчинів електролітів пропорційні загальній концентрації молекул та йонів.
5. Кількісними характеристиками процесу дисоціації є ступінь і константа дисоціації.
|
|
Дата добавления: 2014-01-04; Просмотров: 1437; Нарушение авторских прав?; Мы поможем в написании вашей работы!