
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
З позицій теорії електролітичної дисоціації
|
|
|
|
ВЛАСТИВОСТІ КИСЛОТ, ОСНОВ І СОЛЕЙ
Кожний клас сполук має власні загальні властивості, зумовлені наявністю деякої спільної ознаки. Для кислот цією ознакою є йони гідрогену, які входять до їх складу.
Кислоти – це електроліти, що при дисоціації у якості позитивно зарядженого йона утворюють виключно катіони гідрогену Н+.
Кількість йонів гідрогену, що утворюються при дисоціації однієї молекули, визначає основність кислот. Так, HCl, HNO3, CH3COOH – одноосновні кислоти, Н2S, H2SO4, H2CO3 – двохосновні, Н3РО4, Н3AsO4 – триосновні. Кислоти з більшою основністю зустрічаються рідко.
Багатоосновні кислоти дисоціюють ступінчасто, наприклад, арсенатна кислота:
I ступінь: H3AsO4 Û H+ + H2AsO4–,
II ступінь: Н2AsO4– Û H+ + HАsO42–,
IІІ ступінь: HAsO42– Û H+ + AsO43–.
В розглянутому прикладі не тільки молекула Н3AsО4 є кислотою, але й утворені внаслідок її дисоціації аніони Н2AsО4– і НAsO42– належать до кислот, оскільки при їх дисоціації теж вивільняються йони Н+, що є головною ознакою класу кислот. З позицій теорії електролітичної дисоціації кислоти – це не тільки нейтральні молекули кислоти, але й негативно заряджені аніони, які спроможні дисоціювати з утворенням катіона Н+.
У сильних кислот, які піддаються повній дисоціації, кислотні властивості виявляються більшою мірою, у слабких – меншою. Силу кислоти можна визначити за її константою дисоціації: якщо Кдис > 10–2, кислоту відносять до сильних, якщо Кдис < 10–4 – до слабких. Ті кислоти, константи дисоціації яких лежать у межах 10–2–10–4, називають кислотами середньої сили.
Завдяки наявності йонів Н+ (точніше, гідратованих йонів у вигляді катіона гідроксонію Н3О+), у водних розчинах усі кислоти виявляють спільні властивості:
|
|
|
· здатність реагувати з основами, тобто вступати у реакція нейтралізації, сутність яких виражається скороченою схемою: Н+ + ОН–àH2O;
· взаємодія з металами, розташованими в електрохімічному ряді напруг до водню, внаслідок чого в результаті реакції виділяється водень Н2;
· кислий смак;
· змінення забарвлення індикатору (рис. 6.7), наприклад, забарвлення нейтрального лакмусу у червоний колір.
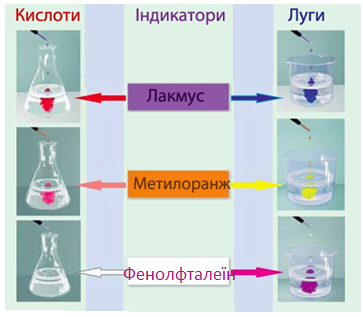
Рисунок 6.7 – Змінення забарвлення деяких індикаторів у розчинах кислот і лугів
Основи – це електроліти, що при дисоціації у якості негативно заряджених йонів утворюють виключно гідроксид-аніони.
Сила основ також характеризується величиною константи дисоціації: чим вище значення Кдис, тим основа сильніша.
Розчинні у воді основи називаються луги. До них належать гідроксиди лужних (Li, Na, K, Rb, Cs) і лужноземельних металів (Са, Sr, Ва), а також хоч і слабка, але розчинна основа NH4OH.
Кількість гідроксильних груп, що входять до складу основи, визначає кислотність основ. Так, КОН – однокислотна основа, Fe(OH)2 – двохкислотна.
Багатокислотні основи дисоціюють ступінчасто:
І ступінь: Fe(OH)3 Û Fe(OH)2+ + OH–,
ІІ ступінь: Fe(OH)2+ Û FeOH2+ + OH–,
ІІІ ступінь: FeOH2+ Û Fe3+ + OH–.
Гідроксильні групи надають основам певних спільних властивостей:
· здатність взаємодіяти з кислотами (реакція нейтралізації);
· відчуття милкості під час дотику;
· змінення забарвлення індикатору (рис. 6.7), наприклад, нейтрального лакмусу – у синій колір, фенолфталеїну – у малиновий.
Особливе місце посідають амфотерні гідроксиди (або амфоліти) (рис. 6.8).
Амфотерні гідроксиди (амфоліти) – це слабкі електроліти, здатні залежно від умов виявляти властивості кислот або основ, тобто дисоціювати з утворенням катіонів Н+ чи аніонов ОН–:
хН+ + МеОхх– Û Ме(ОН)х Û Мех+ + хОН–.
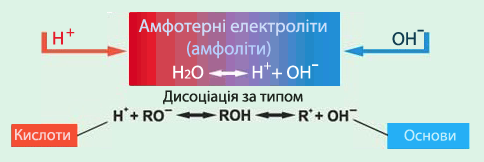
Рисунок 6.8 – Амфотерні основи
Наприклад, у випадку амфотерного цинк гідроксиду дисоціація у водних розчинах може відбуватися по типу кислоти з утворенням гідроксокомплексів чи по типу основи з утворенням аквакомплексів:
|
|
|
2Н+ + [Zn(ОH)4]2– Û Zn(ОН)2 + 2H2O Û [Zn(H2O)2]2+ + 2ОН–,
або у спрощеному вигляді:
2Н+ + ZnО22– Û Zn(ОН)2 Û Zn2+ + 2ОН–,
Отже, у розчині амфотерного електроліту встановлюється складна рівновага, в якій беруть участь продукти дисоціації як по типу кислоти, так і по типу основи. Як приклад амфотерних гідроксидів можна навести такі основи: Bе(ОН)2, Al(ОН)3, Cr(ОН)3, Pb(ОН)2, Pb(ОН)4 тощо.
Солі – це електроліти, при дисоціації яких утворюються катіони металів (або катіон амонію NH4+) і аніони кислотних залишків.
Проте, треба мати на увазі, що це визначення стосується тільки середніх солей, наприклад:
Na3PO4 à 3Na+ + PO43–.
Необхідно пам'ятати, що в рівняннях електролітичної дисоціації середніх солей, більшість яких належить до сильних електролітів і піддається повній дисоціації, замість знака оборотності (Û) записують стрілку (à).
При ступінчастій дисоціації кислі солі (які є продуктами неповного заміщення йонів Н+ у багатоосновній кислоті на метал), утворюють, крім катіонів металу, і йони гідрогену:
І ступінь: KHSO3 à K+ + HSO3–,
ІІ ступінь: HSO3– Û H+ + SO32–.
Основні солі (продукти неповного заміщення груп ОН– у багатокислотній основі на кислотний залишок) теж дисоціюють ступінчасто і утворюють не тільки аніони кислотних залишків, але й гідроксид-аніони:
I ступінь: СаОНCl à CаOH+ + Cl–,
ІI ступінь: СаОН+ Û Cа2+ + ОН–.
Комплексні солі при дисоціації дають комплексний йон (первинна дисоціація), який у свою чергу дуже незначною мірою піддається вторинній дисоціації:
первинна дисоціація: К3[Fe(CN)6] à 3K+ + [Fe(CN)6]3–,
вторинна дисоціація: [Fe(CN)6]3– Û Fe3+ + 6CN–.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1317; Нарушение авторских прав?; Мы поможем в написании вашей работы!