
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конттактты ВХЗ
|
|
|
|
Кесте
| Өнеркәсіптік процестердің мысалдары | Алынатын өнімдер | Маңызды катализаторлар |
I ТҚ реакциялар
А. Тотығу
Толық тотығу
SO2 -ні SO3 тотықтыру
CO- ні CO2тотықтыру
Толық емес тотықтыру
NH3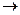 NO тотықтыру
Метанды су буымен тотықтыру
СО- ні су буымен тотықтыру
Метанды ауамен тотықтыру
СН4 ауамен тотықтыру
СН3СОН ауамен тотықтыру
СН2=ОН2 ауамен тотықтыру
Деструктивті тотығу
Нафталинді тотықтыру
Б. Гидрлеу,
дегидрлеу
NH3 Синтезі
Қанықпаған қосылыстарды (СН2=СН2) гидрлеу
Ароматты қосылыстарды (С6Н6) гидрлеу
Майлар мен сұйық майларды гидрлеу
Қатты және сұйық отындарды деструктивті гидрлеу
Октанды деструктивті гидрлеу
Буларда нитробензолды қалпына келтіру
Этилбензолды дегидрлеу
Бутанды дегидрлеу
Гександы ароматтандыру
(дегидрациклизация)
СО+Н2} газдың негізінде синтездеу
II қышқылдық-негізідік реакциялар
В. Гидратация, дегидратация,
гидролиз, поликонденсация
этилен гидратациясы
ацетилен гидратациясы
СН3СООН Дегидратация сы
С2Н5ОН Дегидратациясы
Хлорбензол гидролиіз
формальдегидте фенолды поликонденсациялау
Крегинг және изомеризация,
алкилидеу, полимерлеу
мұнайөнімдерінің каталитикалық крекингі
н-бутана изомерлеу
изобутанды бутиленнен алкилдеу
бензолды пропиленмен алкилдеу
этиленді полимерлеу
изобутиленді полимерлеу
бутадиенді полимерлеу
хлорлы этилды Дегидрохлорлау NO тотықтыру
Метанды су буымен тотықтыру
СО- ні су буымен тотықтыру
Метанды ауамен тотықтыру
СН4 ауамен тотықтыру
СН3СОН ауамен тотықтыру
СН2=ОН2 ауамен тотықтыру
Деструктивті тотығу
Нафталинді тотықтыру
Б. Гидрлеу,
дегидрлеу
NH3 Синтезі
Қанықпаған қосылыстарды (СН2=СН2) гидрлеу
Ароматты қосылыстарды (С6Н6) гидрлеу
Майлар мен сұйық майларды гидрлеу
Қатты және сұйық отындарды деструктивті гидрлеу
Октанды деструктивті гидрлеу
Буларда нитробензолды қалпына келтіру
Этилбензолды дегидрлеу
Бутанды дегидрлеу
Гександы ароматтандыру
(дегидрациклизация)
СО+Н2} газдың негізінде синтездеу
II қышқылдық-негізідік реакциялар
В. Гидратация, дегидратация,
гидролиз, поликонденсация
этилен гидратациясы
ацетилен гидратациясы
СН3СООН Дегидратация сы
С2Н5ОН Дегидратациясы
Хлорбензол гидролиіз
формальдегидте фенолды поликонденсациялау
Крегинг және изомеризация,
алкилидеу, полимерлеу
мұнайөнімдерінің каталитикалық крекингі
н-бутана изомерлеу
изобутанды бутиленнен алкилдеу
бензолды пропиленмен алкилдеу
этиленді полимерлеу
изобутиленді полимерлеу
бутадиенді полимерлеу
хлорлы этилды Дегидрохлорлау
| Күкірт қышқылы (СО- ні залалсыздандыру) Азот қышқылы mCO+nH2 } синтез газ Н2 және азотсутекті қоспа Формальдегид Нас Ацетальдегид Фтальді ангидрид NH3 С2Н6 Циклогексан Қатты майлар Сұйық мотор отындары Бутан Анилин Стирол Бутадиен Бензол Синтин, синтал, метанол С2Н5ОН СН3СОН Сірке ангидрид Диэтилді эфир Фенол Шайыр Авиациялық бензин Изобутан Изооктан Кумол Полиэтилен Полиизобутилен Синтетикалық каучук Этилен | Платина, V2O5, FeO Mn, Cu, Co, Hg тотықтары (гопкалит) Pt, Co және Fe тотықтары Никель Темір мен хром тотықтары Азот оксидтері (NO2), қалайы оксидтері, алюмосиликаттар Cu, Аg марганц және кобальт тұздары Аg, Cu, Cu2О V2O5 Fe Ni, Pt Ni, Mo Ni Fe, Mo, W және олардың оксидтері, сульфидтері Mo және W Оксидтері и сульфидтері Ni, Cu ZnO, хром оксидтері хром оксидтері Pt, Ni, Co, хром оксидтері Fe, Сo, Ni, хром оксидтері және мырыш H2SО4, H3PО4 және оның тұздары HgSO4 Р және сілтілік металдардын карбонильдері, триэтилфосфат H2So4, Al2O3 ,TҺО2 MgCl2, H3PO4, Al2O3 Минералдық қышықлдар мен негізідер Алюмосиликаттар Алюмосиликаттар, AlCl3 и HCl H2SО4 H3PО4 Триэтилалюминий и TiCl4 BF3, AlCl3 Натрий BaF2, CuCl2 |
Гомогенді процестер. Гомогенді химиялық процестердің сипаттамасы. Гомогенді процестер – біртекті ортада өтетін процестер. Ауа – гомогенді жүйе, алайда Rt-RҺ катализаторларында NH3 тотықтыру үшін ауа – гетерогенді жүйе, құрамында шаңдар, ылғал тамшылары және т.б. бар. Бастапқы шикізаттың құрамында процесс жүрісіне катализатор және ингибитор түрінде әсер ететін қосындылар бар.
|
|
|
Гомогенді және гетерогенді жүйелердің арасындағы шекара микрогетерогенді жүйе деп аталатын жіңішке аэрозольдар бойынша өтеді.
Каллоидты бөлшектердің молекулаларға дейін мөлшерінің кішірейуі микрогетерогенді каллоидты ерітінділерді шынайға жақындатады, яғни оларды гомогенді жүйе деп қарастырады. Суспензиялар, эмульсуялар гетерогенді жүйелерег жатады.
|
|
|
Гетерогендіге қарағанда гомогенді жүйелерде реакциялар жылдамырақ жүреді. Жүйені гомогендеу үшін еріту немесе сұйық ерітінді алу үшін қатты материалдарды балқыту үшін қолданылады.
Кейде газды фазаны қолданады және оған сұйықтықтарды буландырады. Мысалы, 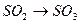

Ассоциация – молекулалардың одан іріректеріне қосылуы. 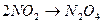 , НNО3 конц синтезі кезінде.
, НNО3 конц синтезі кезінде.
Полимерлену – мономерлердің полимерге қосылу процесі. 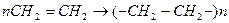
Деполимерлену – полимерден мономерлердің бөлініп қалуы.
Крегинг – деструктивті өңдеу әдісі.
Пиролиз – термиялық ыдырау.
Газды фазадағы гомогенді процестер. Органикалық заттар технологиясында кеңінен қолданады. Органикалық заттарды буландырады және газдармен - Cl2, SO2, азот оксидтері яғни т.б. өңдеуді. Пиролиз нәтижесінде газдық фаза түзіледі яғни процесті гетерогендіге жатқызуға болады. Пиролиз кезінде азда болса қатты көмірсутектер түзіледі.
Хлорлау улы химикаттар мен басқада органикалық синтез өнімдерінің органикалық еріткіштерін алу үшін жүзеге асырылады.
Хлорлаудың негізгі әдістері: термиялық, фотохимиялық және каталитикалық. Оның алғашқы екеуі – гомогенді.
Е акт= 84 кДж/моль, t0= 250-4000С-тағы термиялық хлорлау кезінде 
Бастапқы өнімдердің, қатынастарын өзгерте отырып, реакцияны хлор өндіріс жағына қарай бағыттауға болады. Мысалы, CH3Cl және CH2Cl2 СН4: 400-4500С-та Cl2 = 3-8: 1 қатынасында алады.
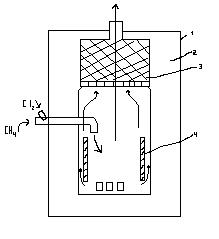
Метанды хлорлауға арналған аппарат
1- Болатты қаптама; 2- шамотты футеровка; 3-қондырғы
(фарфорлы сақиналар); 4-ішкі керамикалық цилиндр
Өнеркәсіпте екі кезеңді процесс қолданылады. Алдымен газды фазада t0-да СН3Cl CH2Cl2 алады, содан-соң фотохимиялық сұйық фазалы хлорлаумен процесті CHCl3 және Cl4 түзілгенше жеткізеді..
Фотохимиялық хлорлау тізбектік механизм бойынша жоғарғы жылдамдықпен орташа температураларда сұйық немесе булы фазаларда жүзеге асырады және реакцияның бағыты термиялық хлорлауға қарағанда басқаша болады.
Е акт 42-63 кДж/моль, яғни төменде.
|
|
|
Сульфохлорлау:
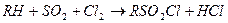 шекті көмірсутектерді еліктіргіш құралдардың өндірісі үшін қолданады. Жарық әрекеті арқылы сұрыптаулы күйде реакцияны сульфохлоридті қию жағына қарай бағыттауға болады.
шекті көмірсутектерді еліктіргіш құралдардың өндірісі үшін қолданады. Жарық әрекеті арқылы сұрыптаулы күйде реакцияны сульфохлоридті қию жағына қарай бағыттауға болады.
1 квант энергида 2000-3000 молекула айналымға түседі (өндірістік жағдайлар үшін).
Негізгі әдебиеттер 1 [197-245], 4 [127-133]
Қосымша әдебиеттер 9 [89-100]
Бақылау сұрақтары:
1. Катализ деген не? Катализатор әсерінің мәні неде?
2. Гомогенді және гетерогенді катализ дегенміз не?
3. Гомогенді каталитикалық процестердің және гетерогенді процестердің жылдамдықтарын анықтайтын теңдеулерді жаз.
4. Катализаторларды дайындаудың қандай негізгі тәсілдерін білесіндер?
5. Ассоциация, полимерлену, деполимерлену, крекинг дегеніміз не.
№8 Дәріс. Химиялық реакторлар: жіктелуі және қойылатын талаптар. Гомогенді газ- және сұйықфазалық процестерге арналған реакторлар. Идеалды және толық жылжыту реакторлары. Әр түрлі гетерофазалық процестерге арналған реакторлар: Г-С, Г-Қ, Қ-С, Қ-Қ, С-С. Химио-технологиялық процестер мен реакторларды моделдеу принциптері.
Кез келген өзара әртүрлі байланысқан машиналар мен аппараттдың толық қатарын бар химио-технологиялық жүйеде орталық аппарат болып химиялық реактор табылады, бұл химиялық процесс жүретін аппарат. Химиялық реактордың түрін, конструкциясын және есебін таңдау, оның жұмысын басқаратын жүйелерді жасау – химиялық технологияның маңызды мақсаттарының бірі болып табылады.:
Сурет 1 – Химиялық реакторлардың схемасы
Г – газ, Ж – сұйықтық, Т – жылутасымалдаушы, Н – қондырма, Тв – қатты реагент, К – катализатор, Хг – салқын газ.
Сурет 2– де барлық реакторларға тән құрылымдық элементтер көрсетілген.
| Химиялық реакция жүретін реакторда бірнеше қабат катализаторлар себілген. Бұл барлық реакторларда болатын 1 реакционды зона. Бастапқы реакциялық қоспа жоғарғы штуцер арқылы беріледі. Реакциялық зона арқылы газдың біртекті өтуін қамтамасыз етуі үшін ағынды таратқыш орнатылған. Бұл 2 енгізу қондырғысы. Реакторда 2 1 суретте көрсетілгендей газды таратқыш болып барботер болып табылады. Араластырғыштарға реагенттердің біртекті қатынасын қамтамасыз ететін ерекше талаптар қойылады. 2 суретте бірінші және екінші қабаттар арасында 3 араластырғышта 2 ағын араласады – бірінші қабаттан кейін салқын газ қосылады, екінші қабаттан кейін жылу алмастырғышқа 4 орнатылады. Өнімдер шығару қондырғысы 5 арқылы шығарылады. Ағындарды бөлу қондырғылары болуы мүмкін. | |
| Реактордың құрылымдық элементтері: 1-реакциялық зона, 2-реакциялық қоспаны енгізу қондырғысы, 3-араластырғыш, 4-жылуалмастырушы, 5-шығаратын қондырғы, ХГ – салқын газ, Т-жылутасымалдаушы, И және П – бастапқы және соңғы өнімдер. | ||
Химиялық реакторлар әр түрлі болады (конструкциясы бойынша әсер ету әдісі бойынша т.б.) алайда реакторлар қызмет етуінің жалпы тәжірибиелік сипаттары бар. Ортақтығы: реакцияның реагенттер мен өнімдерді әкелу тәсілдері, реагенттерді аралстыру режимі, жылуалмасу жағдайлары, температуралық режим, реакцияның реагентері мен фазалық құрамы.
|
|
|
Реакторлар төмен және жоғары температуралы, жоғарғы қысым, төмен қысым және қалыпты қысымда жұмыс жасайтын аппараттар болып бөлінеді. Реакторлар гомо және гетеро процестерге арналады. Ең маңызды сипаттары:
1. Реагенттерді әкелу және бұру тәсілдері.
2. Реагенттерді жылжыту және орын ауыстыру режимдері.
3. Температуралық режим.
Реагентерді әкелу және бұру тәсілдері периодты түрде үздіксіз және жартылай периодты жүзеге асырылады (реакторлар да периодты және жартылай периодты болып табылады).
Периодты әсерлі реакторларда реагенттер операцияның басында ендіріледі. Оларда уақыт бойынша Т,Р, С өзгереді. Бұл реакторлар реагенттер қатты аралсқанда жұмыс істейді.
Үздіксіз әсерлі реакторлар немесе ағынды реакторлар үздіксіз түрде бастапқы затармен қоректендіреді және өнімдерді шығарады. Олардың негізі сипаттамасы көлемдік жылдамдығы: V = Vр / 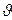 ; Vр –
; Vр – 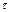 уақыттағы түсетін заттар көлемі;
уақыттағы түсетін заттар көлемі; 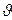 - реактор көлемі.
- реактор көлемі.
Реактордың көлемдік жылдамдығын ағынды реакторлар өнімділіг сипаттай алады.
Жартылай үздіксіз әсерлі реакторларда шикізат үздіксіз немесе бірнеше уақт аралығында бөліктеп түседі, ал өнімдер периодты шығарылып тұрады.
Араластыру режимі бойынша жіктелуі. Араластырудың екі түрі бар – көлденеңен (осьтік) және радиальді (реактор радиусы бойынша).
Идеалды ығыстыру реакторларында реагенттер қабат–қабат болып реактордың биіктігімен және сәйкес реакторда заттардың болу уақытымен анықталатын барлық реакциялық жолдан өтеді. Идеалды ығыстыру реакциялары – құбырлар шахталық пештер, пленкалы абсорберлер мен десорберлер, т.б. ішінде катализаторлы байланыс аппараттары.
Толық ығыстыру реакторлары – бұл қарқынды араластыратын реакторлар, оларда кез келген элемент бір сәтте реактор ішіндегілермен араласып кетеді. 1. Импелярлы араластырғыштар 2.КС пеші 3.Адсорберлер.
Адиабаталық реакторлар қоршаған ортамен жылу алмаспайды, жақсы оқшауланған. Реакцияның барлық жылуы әсерлесетін ағынымен жинақталады. Реактордың биіктігі бойынша кез келген нүктедегі температуралық режим:
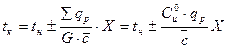
Мұндағы tк және tн - реактордың бастапқы және соңғы температуралары; qp –жылулық эффект; Х- айналу деңгейі; 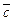 - жылусыйымдылық; G – реакциялық қоспанының жалпы массасы С0u – бастапқы заттың бастапқы концентрациясы.
- жылусыйымдылық; G – реакциялық қоспанының жалпы массасы С0u – бастапқы заттың бастапқы концентрациясы.
Изотермиялық реакторлар реактордың барлық көлемдік жыладамдығында T = const ие. Бұл реакторларда әкелінген жылу реакция жылуына тең болуы керек.
Qp = Kт F ×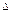 tср ×t = Qп Kт – жылуберу коэффициенті; F – жазықтық;
tср ×t = Qп Kт – жылуберу коэффициенті; F – жазықтық;
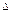 tср – орташа қозғаушы кү; t - уақыт;
tср – орташа қозғаушы кү; t - уақыт;
Политермиялық реакторлар. Оларда реакция жылуы әкелінген немесе бұрылған жылу есебінен біртіндеп орнын толтырады. Аппарат ішіндегі жылу алмастырғыштар
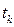 - tн =
- tн = 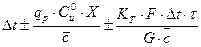
qp=-DHp/n
n – өнімдердің моль сандары.
Шахталық пештер домналар, әк күйдіру процесінің пештері адсорбциямен десорбцияға арналған мұнаралар.
Химиялық реакторларға қойылатын талаптар: барлық реакторлар келесі негізі талаптарды қанағаттандыруы тиіс: 1) ең көп өнімділік пен қарқындылқты қамтамасызе ту; 2) процестің максималды сұрыптаушылығында жоғарғы айналым деңгейін беру; 3) реагенттерді тасымалдауға аз энергетикалық шығындарды жұмсау; 4) қарапайым және арзан болу; 5) экзотермиялық реакциялардың және эндотермиялық процестерді жүзеге асыруға арналған, сырттан әкелінетін жылуды толық пайдалану; 6) жұмыста берік болу, мүмкіндігінше барынша толық механикаландырылған және процесті автоматты реттеуді өамтамасыз ету.
Негізгі әдебиеттер 1 [197-245], 4 [127-133]
Қосымша әдебиеттер 9 [89-100]
Бақылау сұрақтары:
1. Химичялық реакторлар: классификациясы және қойылатын талаптары.
2. Гомогенді газ- және сұйықфазалық процестерге арналған реакторлар.
3. идеальды және толық ығыстыру реакторлары.
4. Әр түрлі гетерофазалық процестерге арналған реакторлар: Г-С, Г-Қ, Қ-С, С-С, Қ-Қ.
5. Химио-технологиялық процестер мен реакторларды моделдеу принциптері.
9 Дәріс. Гомогенді және гетерогенді катализ процестеріне арналған реакторалар. Байланыстырушы аппаратарынң түрлері. Қозғалмайтын (сүзгілеу), қалқымалы (қайнаған) және қозғалатын катализаторлы реакторлар.
Газды фазада гомогенді каталитиклық процестер өтетін аппараттар камералар, колонналар, түтікті жылуалмастырғыштар т.с.с. болуы мүмкін. SO2 гомогенді тотығуы нитрозды әдіспен күкірт қышқылы өндірісінде сұйық, жекелей газды фазада мұнаралардың қондырмаларының еркін көлемінде жүзеге асырылады. Буларды сірке қышқылының эндотермиялық дегидротация процесі бу тәрізді триэтилфосфат катализаторының қатысында жағу газдаруъымен қыздырылатын құбыр аралық кеңістікте айналымда болатын түтікшелі реакторларға жіберіледі. Сұйықфазалы гомогенді катализді әдетте әр түрлі араластырушы қондарғылары бар реакторларды өндіреді. Мысалы, тұз қышықылы катализаторы қатысатында сулы ерітіндідегі фенол және альдегид поликонденсациясы механикалық араластырғыштары бар реакторларға жіберіледі.
Гетерогенді катализ реакторлары, әсіресе қатты катализаторларды газдар әсерлесетін байланыс аппараттары, әр түрлі және өзіндік қасиеттерге ие. Байланыс аппараттары үздіксіз жұмыс жасауы керек. Жоғарғы қарқындылыққа ие болу қажет, процесс режимін қамтамасыз етуі тиіс. Оған қойылатын талаптар: гидравликалық минималды қарыласу, конструкцияның қарайымдылығы және қызмет тетудің жеңілдігі. Гетерогенді каталикалық реакцияларды жүргізуге арналған реакторларды реагенттер мен катализатордың фазалық жағдай бойынша катализатор мен реагенттердің арасындағы байланыс тәсілі бойынша, сонымен қатар жылуалмасу қондырғылардың конструктивті жабдықтау бойынша жіктеуге болады.
Реакторларды фазалық қасиеттері бойынша төрт классқа бөлуге болады.
І. Әсерлесуші орта – газ; катализатор – қатты:
1. Беттік байланыс аппараттары: катализатордан жасалған құбырлар немесе торлар;
2. Катализатордың сүзгілеу қбаты бар байланыс аппараттары;
3. Катализаторлардың қалқымалы қабаты бар байланыс аппараттары;
4. Қозғалмалы катализаторы бар байланыс аппаратары.
ІІ. Әсерлесуші орта– сұйық; катализатор– қатты:
1. Қозғалмайтын катализаторлы аппарат;
2. Қалқымалы қабаты катализаторы бар аппарат;
3. Сұйықтыққа катализатор қосындаларының ағындары бар аппараттар;
4. Араластырғышты аппараттар.
ІІІ. Әсерлесуші заттар– газдар және сұйықтықтар; катализатор– сұйықтық немесе сұйықтықтағы қатты заттардың қосындылары.
1. Қондырмалы колонналар;
2. Араластырғышты реакторлар.
IV. Әсерлесуші заттар – араласпайтын сұйықтықтар; катализатор– сұйық: араластырғышты реакторлар.
Беттік байланыс аппараттарында катализаторлар құбыр немесе тор түрінде орналасады, олар арқылы газ өтеді, сүзгілеу немесе қалқымалы қабатты катализаторлары бар аппаратарға қарағанда сирек қолданылады. Беттік байланыс кезінде катализатордың белсенді беті үлкен емес. Сондықтан мұндай типті аппараттар мақсатты түрде жоғарғы активті катализатор қатысында тек жылдам экзотермиялық реакцияларға қолданылады. Мұндай жағдайда байланыстырушы аппараттарда үлкен көлемде катализаторларды орналастыру талап етілмейді. Аппараттың корпусында көлденеңен бірінін үстіне бірі бірнеше торлар бекітілген, олар берілген металл немесе балқыманың реакциясына арнайы дайындалаған. Тұтану температурасына дейін газ қыздыру ең алдымен аппаратың өзінде қызып тұрған торлардың жылу бөлу есебінен өндіріледі. Торлардың бетімен газдардың жанасу уақыты секундтын мың – он мыңдап үлесін құрайды. Мұндай аппараттар қондарғылары бойынша қарапайым және жоғарғы өнімділікті. Олар платинапаладийлі – радийлі фторларда аммиакты тотықтыру үшін, күміс торларда изопропильді спирттен ацетонды синтездеу үшін, мыс немесе күміс торларында метанолды тотықтыру үшін т.с.с. қолдану үшін қолданылады.
Сүзгілеу қабатта катализаторы бар аппараттар қазіргі кезде ең көп таралған. Олар каталитикалық реакцияалардығ кез келегентипіне қолданылады. Мұндай аппаратарда катализаторлардың қабаты немесе катализаторлардың бірнеше қабаттары қозғалыссыз торлы тіреуде немесе құбырларға қозғалыссыз катализатор арқылы енгізілген күйде жатады. Катализатордың қабаты неғұрлым көбейген сайын газдың осьтік тасымалы азаяды.
Катализаторлар дән, таблетка немесе әртүрлі мөлшерлі гранула пішінді болады, алайда көлденеңі бойынша 4-5 мл– ден төмен болмайды, өйткені одан да кішірек бөлшектерде катализатор қабатының гадравликалық қарсыласуы өседі және оның бірігуі оңайырақ жүреді. Енгізілген катализатордың көлемі, биіктігі, қабаттар саны және аппаратта орналасуы катализатордың белсендігіне, каталитикалық реакцияның сипатына, жылуалмасу шарттарына байланысты. Катализатор неғұрлым белсенді болған сайын тең салмақты шығатын өнім және реакцияның жылдамдығы артады, байланыс массасы соғұрлым азаяды, сондықтан аппараттқа соғұрлым кіші катализатор қабатының биіктігін ендіру керек.
Байланыс аппаратарындарындағы конструкция ерекшеліктері жылуалмасу қондырғыларының жабдықталуына байланысты. Температуралық режимді қолайлы ұстап тұру– байланыс аппараттарын жобалағандағы ең күрделі мақсат. Эндотермиялық реакциялар үшін катализ зонасында жылу әкелуді талап етеді; көптеген каталитикалық процестер үшін кері реакциялардан құтылу үшін реттеу талап етіледі.
Жылуалмасу қондырғыларынсыз сүзгілеу қабаты бар аппараттар конструкциясы бойынша олар адиабаталық жылулық режиде жұмыс істейді, оған қоса температуралық режим бастапқы газдың құрамы мен температураысының өзгерісімен реттеледі. Мұндай аппараттарды қолдануға болады: а) жіңішке қабатты белсенді катализатор қатысында тәжірибие жүзінде қайтымсыз экзотермиялық реакциялар өтетін, мысалы метанолды формальдегидке тотықтыру үшін;
б) реагентердің төмендегі концентрациялы реакциялары үшін, мысалы, газдарды тотықтырумен немесе қосындыларды гидрлеумен каталитикалық тазалағанда;
в) аз жылу эффектісі бар экзотермиялық және эндотермиялыұ реакциялар үшін.
Ендірілген катализаторлардың көлемі оның аз белсенділігінде үлкен болуы мүмкін және қабат биіктігі кейде бірнеше м– ді құрайды. Мұндай аппараттарды адиабаталық режим жүзеге асырылады; сәйкесінше, экзотермиялық процестерінде катализатор қабатында әсерлесуші газадар температурасында х айналу деңгейіне тура пропорционалды. Адиабаталық процесс нәтижесінде температураның жоғарылауынан келесі формуламен есептейді:
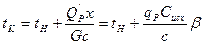 (1)
(1)
Мұндағы 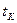 - катализатор қабатынан өткеннен кейінгі газдың соңғы температурасы;
- катализатор қабатынан өткеннен кейінгі газдың соңғы температурасы; 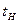 - газдың бастапқы температурасы;
- газдың бастапқы температурасы; 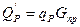 - толық айналым кезіндегі реакцияының жылулық эффектісі
- толық айналым кезіндегі реакцияының жылулық эффектісі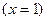 ;
; 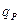 -1 моль өнімге келетін реакцияның жылулық эффектісі;
-1 моль өнімге келетін реакцияның жылулық эффектісі; 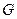 - реакциялық қоспаның көлемі;
- реакциялық қоспаның көлемі; 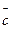 *- тепреакциялық қоспаның жылусыйымдылығы; х - айналым деңгейі; Сисх- түсетін қоспадағы негізігі бастапқы заттардың концентрациясы;
*- тепреакциялық қоспаның жылусыйымдылығы; х - айналым деңгейі; Сисх- түсетін қоспадағы негізігі бастапқы заттардың концентрациясы; 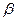 - бастапқа заттың 1 мольнен алынған өнім молінің санына тең коэффицент.
- бастапқа заттың 1 мольнен алынған өнім молінің санына тең коэффицент.
Жылу алмастыру қондырғыларынсыз аппараттар ертеректе көміртек тотықтарының конверсиясы, этиленнің тікелей гидротациясы, табиғи газдың конверсиясы және де басқада біқатар процестер үшін қолданылған. Бұл аппараттардың басымдылығы конструкцияның қарапайымдылығы. Алайда олар қолайлы температуралық режимді қамтамасыз етпейтіндіктен оларды тиімдіректерімен алмастырады.
Байланыс аппараттарында жылуалмасудың бірнеше тәсілдері бар, оған қоса реакциялық көлемнен алынатын жылудың конструктивті кірістері мен жылу әкелу экзотермиялық және эндотермиялық реакцияларды жүргізу үшін біртекті. Жылу бұру тәсілдері бойынша сүзгілеу қатары бары катализаторлы байланыс аппараттарының шамамен жіктелінуі:
І. Жылуды периодты әкелу мен бұрудың байланыс аппараттары.
ІІ. Сыртқы жылуалмастырғыштары бар байланыс аппараттары бар.
ІІІ. Ішкі жылу алмастырғыштары бар байланыс аппараттары.
1. Сөрелік (жылуды сатылы бұру): а) сөрелер арасындағы жылу алмастырғыштарымен бірге,
б) салқын реагентерді қосымша енгізу арқылы сөрелер арасындағы мұздатумен бірге.
2. Түтікшелі (жылуды үздіксіз әкелу немесе бұру): а) түтікшелерде катализаторлардың орналасуымен бірге,
б) түтікше аралық кеңістікте катализаторлардын болуымен.
IV. Бірнеше жылуалмасу қабылдағыштарын біріктіретін байланыс аппараттары.
Негізгі әдебиет 1 [197-245], 4 [127-133]
Қосымша әдебиет 9 [89-100]
Бақылау сұрақтары:
1. Гетерогенді катализ аппараттары дегеніміз не?
2. Жылуды бұру тәсілдері бойынша сүзгілеу жүйелері бар катализаторлы байланыс аппаратарының жіктелуіе атаңыз.
3. Жылуды периодты әкелу және бұру байланыс аппараттарының жұмысын сипатта.
4. Сыртқы жылу алмастырғыштары бар байланыс аппараттарының жұмысн сипатта.
5. Газды қоспалар үшін байланыс аппараттарының жылу химиялық есебінің қандай негізгі элементтерін білесіздер?
6. Катализаторлардың қалқымалы қабатында қайтымды экзотериялық газды реакциялар үшін байланыс аппараттарын есептегенде қандай параметрлерді анықтау керек?
№10 Дәріс. Элетрохимиялық өндірістер. Электролиз теориясы, негіздері. Хлор, күйдіргіш натрий, тұз қышқылы өндірістері. Су электролизі. Элетрокхимиялық метализацияның процестері.
Элетрохимиялық өндірістер. Электролиз теориясы, негіздері. Электрохимиялық деп тұрақты электр тогның әсерімен жүретін химияылқ процестер өндірісі аталады.
Өнеркәсіпте сулы ерітінділер мен балқымалардың электролизі кең қолданыс тапқан.
Бірқатар жағдайларда өндірістің электрохимиялық тәсілдері химиялыққа қарағанда басымдылықтары бар: шикізат пен энергия толығырақ қолданылады. Біруақытта бірнеше бағалы өнімдер өндірілуі мүмкін, химиялық өндіріс кезінде қол жетпейтін өнімдердің жоғары тазалық деңгейі алынады. Көрсетілген артықшылқтарының арқасында элетрохимиялық тәсілде көптеген және әртүрлі өндірістерді қамтиды, ең маңыздылары болып хлор, сілтілер, сутек, оттек, бейорганикалық тотықтырғыштар (перманганаттар, персульфаттар, сутегінің асқын тотықтары және т.б.) алу, металдар, металдардың сәндік және қорғалу қабықшасын алу және рафинирлеу табылады. Электрохимиялық өндірістің негізгі кемшіліктеріне энергияны көп жұмсау; өнімдердің өзіндік құнындағы энергия шығындары айтарлықтай үлесті құрайды. Электрэнергиясын электролиз кезіндегі рационалды қолдану критерийі болып ток және энергия қолдану коэффиценті бойынша шығыс табылады.
Ток бойынша шығыс – электрдің жұмсалаған белгілі–бір көлемінің нәтижесінде электролиз кезінде тәжірибие де алынған Gф затының көлемінің Gт зат көлеміне қатынасын айтамыз. Ток бойынша шығыс пайызбен өлшенеді:
ή = G ф/Gт (1)
G т (кг) алынған заттың теориялық көлемі келесі формулмен анықталады:
Gт = I τT/1000 (2)
Ι-ток күші, А; τ –электролиз ұзақтығы, сағ; Е – 1 А*сағ электродтан өткенде бөлініп алынатын заттарының көлемін есептейтін электрохимиялық эквивалент (хлорға 1.323, күйдіргіш натрий 1.492, сутек 0.0376).
Ток күші неғұрлым көп болса, берілген типтегі электролизерді пайдаланғандағы алынуға болатын өнімнің көлемі соғұрлым көбееді.
Хлор, күйдіргіш натрий, тұз қышқылы өндірістері. Хлорлы натрийдің сулы ерітінділерін электролиздегенде хлор, сутек және күйдіргіш натр алынады. Хлор атмосфералық қысымда және қалыпты температурада тұншықтырғыш иісті сары–жасыл түсті газ. Хлордың қалыпты жағдайдағы 3.21 кг/м3. Атмосфералық қысымда хлордың қайнау температурасы –33.60С, қату температурасы –1020С. Хлор суда, органикалық еріткіштерде ериді және жоғары химиялық белсенділікке ие.
Хлор өндірісі үшін ең алдымен қатты тұздарды табиғи тұздықтарды ерңту арқылы алынатын ас тұзының ерітінділері жатады. Ас тұзының ерітінділер лаыну тәсілдеріне тәуелсіз кальций және магний қосындыларының тұздары болғандықтан олар осы тұздардан алдын–ала тазартылуға ұшырайды. Электролиз процесі кезінде кальций және магний гидрототықтары түзілмес үшін тазалау қажет.
Хлор, күйдіргіш натрий, тұз қышқылы өндірістері. Хлорлы натрийдің ерітіндісінің электролизі болатты катод және графитті анод ванналарында жүруі бір аппаратта күйдіргіш натр, хлор және сутек алуға мүмкіндік береді. Хлорлы натрийдің сулы ерітіндісінен тұрақты электртогы өткенде хлордың бөлінуін күтуге болады 2 Сl - -2е =Сl 2, сонымен қатар оттегінің 2ОН-–-2е→½О2 +Н2О немесе сутегінің Н2О –2е →½О2 +2Н+.
Ерітіндідегі хлорлы натрийдің концентрациясын артырғанда хлорды бөліп алу жеңілдетіледі, теңдік потенцияалының көлемінің азаюына әкеледі. Графитті анодтарда оттектің артық болуы хлорға қарағанда көбірек сондықтан оларда газтәрізді хлордың бөлінуімен жүретін хлор иондарының негізгі разряды өтеді. Катодта сілтілік ерітіндіде молекулалық судың ыдырауы жүреді.
Н2О +е = Н+ +ОН –
Рекомбинациядан кейінгі сутек атомдары молякулярлы сутек күйінде бөлініп шығады 2Н+ →Н2
Қатты катодта сулы ерітінділерден натрий иондарының бөлінуі мүмкін емес, сутегі мен салыстырғанда ыдырау потенцияалы жоғарырақ. Сондықтан ерітіндіде қалатын гидрооксильді иондар натрий иондарымен сілті ерітінділерін түзеді. Нәтижесінде, хлорлы натрийдің ыдырау процесі келесідей:
2Н2О +2 ΝаСl → Сl2 +Н2 + 2NаОН,
Яғни анодта хлордың, катодта сутек пен күйдіргіш натрдің түзілуі жүреді. Электролизде негізгі реакциялармен қатар жанамалар да жүреді. Анодта бөлініп алынған хлор жекелей электролитте ериді және реакция бойынша гидролизденеді
Сl2 + Н2О ↔ НОСl + НСl
Қосымша реакциялардың өтуін азайту үшін катод және анод өнімдерінің аралсуына кедергі болатын жағдайлар туғызу керек, оған диафрагммамен катод мен анод кеңістіктернің бөлінуі және анодқа қарай ОН- дарының кері қозғалыс бағытында электролитті сүзгілеу жатады. Мұндай диафрагмалар сүзгіш диафрагмалар деп аталады және асбестен жасалынады. Электролиздің температурасын және электролиттерде хлорлы натрийдің концентрациясын көтеру арқасында хлордың ерігіштігі төмендейді сонымен қатар каталитте күйдіргіш натр концентрациясы төмендейді, бұл қосымша реакциялардың өту ықтималдығын қысқартады. Электролиздің температурасын арттыру ток бойынша шығысты ғана емес, электролиттің электр өткіздігіштігің күшейтеді, оның арқасында ваннадағы жүктеме азаяды. Сонымен, температураны арттыру элекртэнергиясының шығының азайтатындықтан хлорлы натрий ерітінділерінің электролизін 70-800С температурада өткізеді.
Хлорлы натрий ерітіндісінің сынап катоды және графит анодының ваннасы диафрагма ваннасына қарағанда концентрленген өнім алуға болады.
Хлорлы натрий ерітіндісін үздіксіз электрлік токтан өткізгенде графитті анодта келесі газды хлордың бөлінуімен хлор ионының разряды жүреді:
2 Сl - -2е =Сl 2
Сынап катодында сутектің бөлінуі үлкен қуаттылықпен жүреді. Егер темір катодта нейтралды ерітіндіден сутектің бөліну плтенциялы 0.415 в ға тең, ал сынап катодында 1.7-1.85 в тең. Снапта натрий деполяризациясының үлкен әсерімен бөлінеді. Артық сынапта еритін натрий амальгамасының түзілуімен байланысты болады. Осыған байланысты сынап катодында натрий разрядының потенциялы теңдік салмағынан төмен болады, салмақты потенциял 2.71 в ға тең. Осылай сынап катодында келесі реакциялар жүреді:
Nа+ + е → Νа, Νа + nНg = NаНgn
Және сутек бөлінбейді. Сынап электродының ваннасында орташа есеппен электролиз 4.3 –4.4 в кернеулікпен жүреді.
Таза сілті керек болған жағдайда сынап катодта ваннаға береді. Электролиз нәтижесінде ерітінді түрінде алынған сілті булы аппаратта концентрленуге ұшырайды. Дифрагмалық ваннада сілті 130 г/л күйген натрий және 180 г/л хлорлы натрийден тұрады. Тәжірибе сілтілі булаудан және балқудан кейін 92-94% NаОН және 2-3% NаСl бар сілті алынады. Сутек алдыңғы өңдеусіз сутек тұтынушыға беріледі. Хлор сулы буға қаныққан. Хлорды кептіру 2 сатыдан тұрады: алдымен оны 200С ға дейін салқындатады, ал кейін соңғы кептіру үшін қондырмалы мұнараға жіберіледі. Кепкен хлор тұтынушымен алынады. Хлорды 3 әдіспен күйдіреді: 10 –12 ат қысымда және 5 тен – 250С қа дейін. Сұйық хлорды болатты балонға және цистерналарға құйып, тұтынушыға жіберіледі.
Негізгі әдебиеттер 1 [197-245], 4 [127-133]
Қосымша әдебиеттер 5 [89-100]
Лекция 11.Күкірт қышқылының өндіру әдістері. Колчеданды жағудағы материялды және жылу балансы. Жылу балансының диаграммасы. Өндірістегі баланс әдісінің технологиялық схемасы.
Күкірт қышқылының қасиеті  немесе
немесе  98,08 г.
98,08 г.
Сусыз 
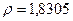 г/см3 200С болғанда,
г/см3 200С болғанда, 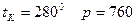 мм рт.с және +10,450С ғы кристалдандыру
мм рт.с және +10,450С ғы кристалдандыру 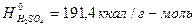 . С = 0,338 кал/г град 200С да.
. С = 0,338 кал/г град 200С да.
Еру жылулығы 22ккал/моль.
 құрылғы 2000С дейін > жоғары температурада ыдырайды.
құрылғы 2000С дейін > жоғары температурада ыдырайды.  =SO3+H2O.
=SO3+H2O.
Күкіртқышқылының техникасы деп ерітінділер ( +H2O) аталады.
+H2O) аталады.
Ерітінділер  +SO3- олеум.
+SO3- олеум.
Олеумнің құрамы – бұл SO3 тің қасиеті 100% жоғары  (таразылық %).
(таразылық %).
Жалпы мазмұны 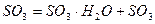 бос.
бос.
Т кристалдану:  - сумен 3 байланыс құруы:
- сумен 3 байланыс құруы: 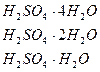
Ал SO3 – пен 2 байланыс 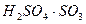 және
және 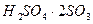 - бұл қосылыстарға ең жоғары кристалдану температурасы жатады.
- бұл қосылыстарға ең жоғары кристалдану температурасы жатады.
Сонымен 75%  (-410С) да кристалданады, 98%
(-410С) да кристалданады, 98%  +0,10С.
+0,10С.
93,3  (-37,850С) да кристалданады, олкум құрамына SO3 18,07 (-17,050С) да.
(-37,850С) да кристалданады, олкум құрамына SO3 18,07 (-17,050С) да.
Қайнау температурасы ерітіндіні қыздырғанда, құрамындағы < 70%  қайнау температурасына дейін тек
қайнау температурасына дейін тек  бөлінеді, 98%
бөлінеді, 98%  ерітіндісінің үстінен және бу мен
ерітіндісінің үстінен және бу мен  . Будағы қатынас
. Будағы қатынас  :
: 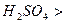 , сұйықтыққа қарағанда.
, сұйықтыққа қарағанда.
Атомдық қысымда ерітінді 1000С қайнайды. (93,3% дейін). Егер қышқыл >, мысалы, 93,3% азеотропты қосылыс түзіледі tқайнау 338,80С. Сондықтан,  ерітінділерін қайнатқанда соңында концентрация 98,3%. SO3 көбейген сайын tқайнау төмендейді. Жіберілетін
ерітінділерін қайнатқанда соңында концентрация 98,3%. SO3 көбейген сайын tқайнау төмендейді. Жіберілетін  тауарлық сорты tқайнау (р=1 атм):
тауарлық сорты tқайнау (р=1 атм):
Мұнаралық (75%) – 187,8 0С,
Купаросты май (92%) – 274,70С,
Олеум (20%бос) – 216,6.
Мағынасы: Химиялық тыңайтқыштар, мұнай өнімдерін тазарту, бояғыштар, фарсацевтік препараттар, ВВ, басқа қышқылдар(HF, HCl, H3HO4) гидрометаллургиясы.
H2SO4 тәсілдері:
Нитроздық тәсіл
Күкірт қышқылының сорттары: тағам өнімінің купоросты майы
Аккумальды қышқыл
Реактивті қышқыл.
 анализі: NaOH 0,5 Н (SO3, Fe, As, NO, NO2).
анализі: NaOH 0,5 Н (SO3, Fe, As, NO, NO2).
Сулы ерітіндідегі SO3 құрамын  - ті санау, SO3 тің жалпы мөлшері SO3 артық болуы, немесе
- ті санау, SO3 тің жалпы мөлшері SO3 артық болуы, немесе  тің бар болуы және теріс санау.
тің бар болуы және теріс санау.
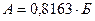 (1) А-
(1) А-  сулы ерітіндіде SO3 тің жалпы мөлшері.
сулы ерітіндіде SO3 тің жалпы мөлшері.
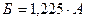 (2) Б-
(2) Б-  сулы ерітіндіде
сулы ерітіндіде  тің жалпы көлемі немесе олеумдағы %.
тің жалпы көлемі немесе олеумдағы %.
В – олеумдағы SO3 тің жалпы мөлшері.
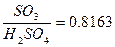 ;
; 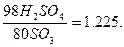
 (3)
(3) 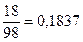
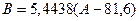 (4)
(4) 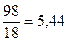 .
.
Сусыз  - түссіз, сұйық,
- түссіз, сұйық, 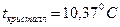 ,
, 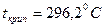 теріс азеотроптағы
теріс азеотроптағы 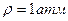 болғанда:: 98,3%
болғанда:: 98,3% и H2O
и H2O 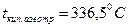 .
.
 сулы ерітінділерінің кристализациялану температурасы – бұл
сулы ерітінділерінің кристализациялану температурасы – бұл 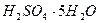 ,
, 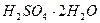 ,
, 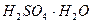 ,
,  қосылыстары.
қосылыстары.
Күкірт қосылысының өндірісі: Күкірт және оның көптеген қосындылары әртүрлі қолданысқа ие. H2SO4 тің мөлшері 50% дейін H2SO4 өндірісіне жұмсалады., 25% -ке жуығы әкпен әрекеттескенде Ca(HSO3)2 ке айналатын SO2 ті алуға, ал қалғаны фунгицидті алу және каучукты вулканизациялау,а қолданылады.
Күкірт қышқылы. Негізгі химиялық өндірістегі басты өнім. H2SO4 тің басты тұтынушысы минералды тыңайтқыштарды өндіру – суперфосфат Са(Н2РО4)2 және алюминий сульфаты және калий өндіру тәсіліне қарай мұнаралы және түйіскен күкірт қышқылы болып бөлінеді. Түйіскен қышқылды мұнай өнімдерін, коксохимиялық өнімдерді, сонымен қатар, түсті металдарды тазартуда қолданылады. Күкірт қышқылымен оргаикалық қосылыстарды сульфирлейді, алынған заттар суда жақсы ериді (бояғыштар, дәрі дәрмектер, жуғыш заттар және т.б); органикалық синтез өндірісінде катализатор ретінде және вискозды талшықты дайындауда қолданылады.
Күкірт колчеданы– FeS2 - ~ 53,5%
- күкірт – S ~20%
- шығарылатын газдар (түсті металдар ошағынан) – SO2 ~26,5%
- күкіртсутегі - H2S
Күкірт колчеданын тотықтырып күйдіру
2FeS2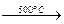 2FeS+S2
2FeS+S2
S2+2O2®2SO2
4FeS+7O2®2Fe2O3+4SO2
S4FeS2+11O2®2Fe2O3+8SO2+Q
Үлкен өнімділік және күйдіру тегістігі ошақтың қайнау қабатында жетеді. Реакция экзотермиялы болғандықтан, жылуды шығаруды қамтамасыз ету қажет, t>900 оС болғанда концентрация күйіп кетеді. «қайнау» қабатында барлық процестер тез және толығымен жүреді, ал температура барлық жерде бірдей. Осындай артықшылықтарының арқасында өнеркәсіптерде тек химмялық реакцияларды жүргізуде емес, өнімді кептіруе, шикізатты классификациялауда, оны тасымалдауда және т.б өндірістерде кеңінен таралған.
Күкірт қышқылын түйіскен тәсңл арқылы өндіру.
Күйдіретін газдарды арнайы тазарту.
As2O3 (tбалқу 315 оС) және SeO2 (tбалқу. 340 оС) газын қатты күйге ауыстыру үшін алдымен салқындатып, кейін барлық қосындыларды жою керек. Осы операция газды салқын сумен жу,анда бірігеді. Бір аппараттан екіншісіне теріс токпен жылжитын және түзілген күкірт қышқылын еру нәтижесінде қосындылармен ластанған 70 оС ты қышқылға айналады. Жуылған 70% ты қышқылды бөлініп тұруынан жартылай сұйық шөгіндіден селен алады. Оны фотоэлементті, тегістегішті, шыны өндірісінде пайдаланады.
Ылғалдандырғыш мұнарада газ су буымен толығады, түйіскен аппаратта түзілетін SO3 оксиді мен күкірт қышқыл тұманын береді.Сондықтан түйіскен аппаратқа түспей тұрып газ кептіргіш мұнарады 98%-ды H2SO4 кептіріледі.
Түйіскен тотығу SO2
Реакция 2SO2+O2«2SO3+Q.
Катализатор қатысуымен t>400 oC да көрінетін жылдамдықмен жүреді. Катализатор ретінде активтілігі аз V2O5 қолданылады. Қолданылатын БАВ түйіскен массаның құрамына (барий, алюминий, ванадий) активатор- сулбфаттар К,Ва, Al кіреді. Бұл заттар аморфты кремнеземнің поралық қабатында орналасқан.
SO3 жұту. SO3 жұтуы жүргізілгенде, шығыны шығарылатын газдарда аз болуы қажет SO3 таза оксиді сумен қосылғанда жылу көп мөлшерде бөлінеді. Бірақ N2, O2 газы мен ерітілген SO3 булары сумен жұтылмайды. Бұл былай түсіндіріледі: N2, O2, SO3 газдары судан өткен, су буымен қанығады да SO3 пен араласып, H2SO4 тұман түрінде береді.
Сұйылтылған H2SO4 ты жұтуда пайдаланса, осыған ұқсас құбылыс байқалады. Су буының парциялды қысымы. Минималды болатын H2SO4 концентрациясы 98,3% ке жеткенше бұл құбылыс жалғаса береді. Осындай концентрациядағы қышқыл SO3 жұтуда қолданылады. Алдымен газы салқандатып, кейін сақиналы 2 жұтқыш мұнарадан кезекпен өтеді.
Нитрозды (мұнаралы) тәсілмен күкірт қышқылының өндірісі. Бұл тәсілмен өндірілгенде күйген газ электрофильде шаңнан тазарғаннан соң арнайы тазартудан өтпейді. Себебі мұндағы(As2O3, SeO2, SO3 сулы бу) қосындылары процестің барысында әсер етпейді және ауамен сұйылмайды. 350-400 оС температурадағы газ 7 мұнарадан тұратын жүйеге түседі. Мұнара биіктігі 14-16 м болатын цилиндр, және диаметрі 4,5 тен 8 м дейін, керамикалық сақинасы бар, футерленген қышқылға тұрақты кірпіштер. Барлық мұнарадан газ жоғарыдан, төмен қарай қондырмалармен жүретін сұйықтық, тек 4- мұнара бос болады. Сұйықтық қондырмаға арнайы қондырғылар арқылы шомылады, бірінші 3 – мұнарада (өнімділік) Н2SO4 түзіледі және сұйықтықтан өтетін газға NO және NO2 азот оксидтері бөлінеді. Олар күкірт қышқылымен ұсталып қалады, одан соң өнімділік мұнараларына қайтады. Бұл 2 оксид күкірт қышқылымен бөлек жұтылмайды. Бірақ толық жұтылу тек эквимолярлы мөлшерде болғанда жүзеге асырылады. NO және NO2 оксидтері бұл жағдайда Н2SO4 пен реакцияға түсетін, N2O3 ке айналады. Ол үшін (ІІ) азот оксидінің ауамен тотығуы қажет.
2 NO + O2 «2 NO2 + Q
Төмен температурада реакйия толық, бірақ жай жүреді. Газдыұ бос тотығу мұнарасынан (төртінші) өтуі NO ның жеткілікті деңгейде тотығуын, қатынасты реттей отырады. 2 оксидтің қатынасын реттеу үшін, газдың бір бөлігі мұнараның жанынан бос каналдан (байпастан) тез өтеді және азот оксиді тотығып үлгермейді. ІІ азот оксиді қоңырға боялған, IV азот оксиді түссіз болғандықтан, екі ағынның да орнын ауыстырғаннан кейін газдың қалың қабатының бояуын бақылап және әртүрлі құрамдағы қосылыстардың түсті этанол шкаласымен салыстырып, тотығу процесінің дұрыс жүруін қадағалайды.
Қайтымды реакцмяның тепе теңдігі
NO + NO2 «N2O3
N2O3 оксидінің ыдырау жағында жылжыған және оның құрамында қосылыстардың болу ықтималдығы өте аз, бірақ (Н2SO4 күкірт қышқылымен тез әрекеттесу нәтижесінде нитрозил күкіртті қышқыл түзіледі: 2O=N-OSO2OH:
N2O3+ 2 Н2SO4 «H2O + 2 O=N-OSO2OH + Q
Нитрокүкірт қышқылы күкірт қышқылының және ерітінді нитроза (осыдан процестің аты нитрозды)деп аталады.Кері ток принципін қолданады.азот лксидін жұтатын, қышқылдық қозғалысы, вентилятордың әсерімен жылжитын, газға теріс жүреді. Бірінші өнімділік мұнарасынан шығатын үлкен концентрациядағы тоңазытқыштағы салқындатылған Н2SO4 жұтылу, яғни үшінші мұнараны сулауға бағытталады. Екінші жұтылу мұнарасынан ағатын нитроза 77 %-ды күкірт қышқылымен араласады және бірінші жұтылу мұнарасын сулады.Күкірт қышқылының бүркінді және тұманы электрофиьмен ұсталып қалады. Оксидтің аз бөлігі аулаудың толық болмағандығынан атмосфераға кететін газ кетеді және оның орнын басу үшін HNO3 Н2SO4 қосындысымен өнімділік мұнарасына енеді. Барлық үш өнімділік мұнарасына нитрозамен суланған қондырмалар, ыстық күйген газ және судың аз мөлшері ұосылады. Оның көп бөлігі (70 %) концентраторға қосылады. Ал аз бөлігі денираторға 2 мұнарадан өткен соң салқындаған газ 2 өнімділігі мұнарасына кіреді. Барлық мұнарадан нитрозин күкірт қышқылының гидролизі жүреді және күкірт пен азот қышқылдарының қосылысы түзіледі:
O=N-OSO2OH + H2O «HNO2 + H2SO4
Күкіртті газ ағнды қышқылда еріп және құрамындағы сумен араласып, күкірт қышқылы түзіледі: SO2 ® SO2 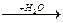 H2SO3,
H2SO3,
Газ ерітінді ерітінді
Азотты қышқыл күкірт қышқылына дейін тотығады. H2SO3 + 2 HNO2 = H2SO4 + H2O + 2 NO
Азот оксиді бөлінеді. Ол газдың құрамындағы оттегі NO2 ге дейін тотығады.
Күкірт қышқылының түзілуі біртіндеп суйық фазада жүреді, ол мұнараның мол сулануымен түсіндіріледі. Қышқылдың мөлшері барлық мұнара жүйесіне берілетін 50-60 есе тәулікті өндіруінен асады. Дайын өнімді алу үшін, денитратор қолданылады, онда тек нитрозаның аз мөлшерін береді, тәуліктік өнімділік жүйесіне сәйкестеп алады. Жоғары температура әсері мен күкіртті газдың артылуымен қышқылдың денитрациясы жойылады.
Келтірілген схемадан күкірт қышқылының өндірістегі негізгі стадиялары болып саналады:
- Азот оксидінің (ІІ) тотығуы;
- Азот оксидінің күкірт қышқылымен жұтылуы;
Екі түйіспелі және мұнаралы тәсілдерін салыстыра отырып, бірінші тәсілде таза және концероген (мышъяк қосылысы жоқ, селен, темір және басқа қосылыстары жоқ) қышқыл және олеум алынады.
Күкірт қышқылының екі тәсілде бірдей. Мұнаралы қышқыл өндіріс орнында көбінесе тыңайтқыш және тұздарды өндіруде қолданылады. Түйіспелі тәсілдің көрсетілген артықшылықтарына байланысты, түйіспелі жүйемен өндіру көбейіп келеді, себебі мұнаралы жүйемен заводтар салынбайды.
Негізгі әдебиеттер: 2[289-315], 4 [127-133]
Қосымша Әдебиеттер 5 [89-100]
Бақылау сұрақтары
1 Күкірт қышқылының қандай физика химиялық қасиеттері бар?
2 Күкірт қышқылын алудағы 2 тәсілінің сипаты
3 Күкірт қышқылын екі тәсілмен алудағы негізін қандай реакциялар құрайды?
4 Колчеданды күйдірудегі материялдық баланстың қандай параметрлері бар?
5 Колчедан күйдіруінің қандай параметрлерін жылулық балансына енгізу керек?
6 Күкірт қышқылын алудағы түйіспелі әдістің сипаттамасын беріңіз?
7 H2SO3 ті алудың қандай әдістерін білесіздер? Ұқсастығы мен айырмашылығы неде?
Лекция 12. Байланысқан азоттың технологиясы. Атмосфералық азотты фиксациялау әдістері. Аммиактың өндірістік синтезі. Азот қышқылының технологиясы.
Жоғары температурадв азот ауа оттегімен байланысты мына реакция теңдеуімен жүреді: N2+O2→2NO-179,2 кДж, осыған доғалық әдіс негізделген. Азот тотығы 2 тотығына дейін тотығады, НNО3 түзілуімен су жұтылады. Жоғарғы температурада азот ауа оттегімен мына әдіске негізделген. Азот тотығы 2 азот.
Бұл әдіс азот тотығы аз бөлінген соң және электрлік доға түзілуіне үлкен электр энергиясы жұмсалғандықтан, көп қолданылмайды. Бірақ қазіргі уақытта плазмалық процестің негізінде жоғары температурадағы ауа оттегі мен азоттың тотығу әдімі жаңаруда.
Цианамидтік әдіс. Ұсақталған калций карбиді азотпен 10000С температурада өзара әсерлесуіне негізделген.
СаС2+ N2 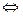 СаСN2+С+301,5 кДж
СаСN2+С+301,5 кДж
Қазіргі уақытта байланысқан азот өнеркәсібінде бұл әдістің мәні маңызды емес.
Аммиактық әдіс. 1913 ж Германияда ең алғашқы аммиак синтезінің заводы ашылды. Аммиак синтезі келесі теңдеумен өтеді:
N2+3Н2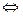 2 NН3+Q
2 NН3+Q
Аммиак ситезі үшін азот пен сутек келесі қатынаста болуы керек: N2: Н2 = 1: 3. Аммиак өндірісінде сутекті азот қосылыстарына қажет азотты алу үшін принципиальды екі түрлі әдіс пайдаланылады:
1. Ауаны азот пен оттегі физикалық бөлу.
2. Сутекті алу жолымен ауа оттегі, СО2 түрімен байланыстыру бірге келесі сутекті азот қосылысының СО2 ден бөлінуі. Сутек көзі болып метан және оның гомологтары сулы және жартылай сулы газдар, су, кокстық газ табылады.
Азот және оттегіні ауаны бөлу арқылы алу.
Балқу, қайнау температурасы О2, Ar и N2 ұшін сыну нүктелері.
Температура плавления, кипени и критические точки для О2, Ar и N2
| Газ | Балқу Температурасы 0С | Қайнау Температура, 0С | Сыну нүктелері | |
| Температура, 0С | Қысым, Н/м2 | |||
| Оттегі………….. Аргон……………… Азот………………… | -218,4 -189,2 -209,9 | -182,95 -185,7 -195,8 | -118,8 -122,7 -147,8 | 5,135∙104 4,96∙104 3,46∙104 |
Сутегі және сутекті азот қосылысының өндірісі:
Метан конверсиясымен сутекті алу. Метанмен сулы будың және оттегімен әсерлесуі келесі негізгі реакциялар арқылы жүреді:
СН4+Н2О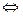 СО+ 3Н2-206 кДж (а)
СО+ 3Н2-206 кДж (а)
СН4+0,5О2 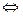 СО+2Н2+35 кДж (б)
СО+2Н2+35 кДж (б)
Метан гомологтарының реакциясы көрсетілген тотығуларға ұқсас жүреді. Содан кейін сулы бумен көміртек тотығының конверсиясының теңдеу реакциясы жүреді:
СО+Н2О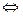 СО2+4Н2+41 кДж
СО2+4Н2+41 кДж
Сулы бумен СН4 конверсия процесі жылуды жұтумен жүреді.
СН4+Н2О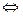 СО2+4Н2-165 кДж
СО2+4Н2-165 кДж
СО және Н2 алынатын метан конверсиясын атмосфералық және жоғарғы қысымда, катализаторлармен және катализаторларсыз жүреді. Аммиак синтезі процесі жүру үшін құрамында 0,5% дан төмен СН4 бар, сутекті азот қосылысы керек немесе синтез бөлісіндегі үрлеу нәтижесінде, газдың үлкен шығыны болады.
Метаннның қалдықты құрамы процестің температурасымен анықталады және будың қатынасы байланысты: газ және қолданылған қысым.Мтан құрамының керекті тепе теңдігі 800-10000С ткмпературада жетеді, алайжа метан конверсиясының жылдамдығы бұл теапература аймағында катализаторсыз өте аз болады. Катализаторлар ретінде бұл процесте алюминий тотығына немесе магний тотығына жағылған никель қолданылады. Бұл жағдайда табиғи газдың заводқа берілетін өзіндік қысымы қолданылады.Ол аммиак өндірісіндегі газды қысуға жұмсалатын электрэнергиясының шығынын біраз қысқартады. Жоғары қысымда аппараттың және құбырдың көлемі кемиді.
Қолданылатын тотықтың құрамына қарай метанның каталитикалық конверсифсы шахталық конвенторлармен бір сатыда жүргізілетін бу оттекті және 2 сатыда жүргізілетін оттексіз деп бөлінеді.Метанның бу оттекті конверсиясында эндотермиялық реакция нәтижесінде шығынға ұшыраған жылу шахтналық конверторда жүретін метан оттегі мен тотығу экзотермиялық реакция арқылы толығады. Шахталық конверторға, ауаны бөлу цехында алынатын табиғи газ, бу және оттегімен қаныққан ауа қоспалары беріледі. Катализатордың жоғарғы қабаттарындағы температура 1050-11000С аралығында сақталып тұрады, ал конвертордың шығуында 800-ан кейін алынатын конвентрленген немесе газогенераторланған газ 20 дан 40% ға дейін көміртектен тұрады. СО ның сулы бумен әсерлесуі қайтымды экзотермиялық реакциямен жүзеге асады:
СО+Н2О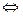 СО2+Н2+36,6 кДж (5000С)
СО2+Н2+36,6 кДж (5000С)
СО ның конвекция реакциясы кезінде газдың көлемі өзгермегендіктен, қысым жоғарылағанда процестің жылдамдығы, сутектің тепе теңдігіне әсер етпей жоғарылайды. Газда қоспадағы сулы будың көбеюі СО конверсиясының толық жүруіне ықпал етеді, температураның жоғарылауы реакция тепе теңдігін сол жаққа, яғни қажетті емес жаққа жылжытады. Алайда төмен температурада бұл реакция катализтор қатысса да өте баяу жүреді.
Негізгі әдебиеттер 2 [289-315], 4 [127-133]
Дополнительная литература 5 [89-100]
Бақылау сұрақтары:
1. Байланысқан азот технологиясының қысқаша сипаты
2. Атмосфералық азотты фиксациялаудың негізгі әдістері
3. Аммимактің өнеркәсіптік синтезі және азот технологиясын сипаттаңыз.
Лекция 13. Органикалық шикізатты өңдеудегі химиялық технологиялар.Біріншілік және екіншілік мұнай өңдеу процестері.Мұнайхимиясы пәні мен міндеттері.Коксохимиялық технология.
Органикалық шикізатты өңдеудегі химиялық технологиялар. Органикалық шикізатты өңдеудегі химиялық технологиясы келесі салалардан тұрады.
- Құрамында көмірі бар қазбалы шикізатты өңдеу қатты отынды, мұнайды және газды- алғашқы бөліну көмірсутек шикізатының суиекке конверсиясы
- Мұнайдың химиялық синтезі – органикалық өнімдерді және жартылай өнімдерді, газды, сұйық және қатты көмірсутектерді өңдеу негізінде, сонымен қатар, көміртек және сутек тотығының негізінде өндіріледі.
- Негізгі органикалық синтез – органикалық шикізаттың терең өңдеу процестеріне бастау беретін, органикалық синтездің базалық өнімдерінің өндірісі.
- Биотехнология – тағам ашытқыларының, аминқышқылдардың, ферменттердің, антибиотиктердің, өндіріс және биологиялық процестердің негізі.
- Жіңішке органикалық синтез – органикалық препарат, реактив, дәрі дәрмек заттардың, өсімдіктің қорғаныс заттарының және т.б заттар өндірісі.
- Органикалық жарты өнімдер мен бояғыштар технологиясы
- жоғары молекулалы байланыстардың технологиясы(СК, пластмассалар,химиялық талшықтар, плёнка түзуші заттар).
- Жануар және өсімдік ішкі затын өңдеу технологиясы
Мұнай өңдеудің біріншілік және екіншілік процестері.
Органикалық заттарды өндірудегі алғашқы ішкі зат болып табиғи газ, мұнай, тас көмір, торф және аз мөлшерде жаңғыш тақта тас болып табылады. Алғашқы өңдеудің салтты дәстүрінің бірі пиролиз. Соңғы жылдары барлық аталған шикізаттар түрлерінің бу оттекті конверсия жолымен алынатын синтез- газ кеңінен таралуда. синтез- газ – шикізат балансын өнеркәсіптік, органикалық өнімнің 90%. Құрайтын, базалық өнімі топтарының органиккалық синтезін алудың негізі болып табылады. Осыған этилен, пропилен, 1,3-бутадиен, бензол, толуол и ксилол жатады.
Біріншілік процестер мұнайдың химиясын өзгертпейді және фракцияларға физикалық бөлінуін көрсетеді. Мұнайдың бірінілік сепарациясы деп – өнеркәсіптік мұнайдың мұнайлық газдан, судан және механикалық қоспалардан тазаруы, яғни алғашқы технологиялық тазарту процесінен өтуін атайды.
Мұнайды дайындау. Мұнай НПЗ ға тасымалдауға дайын түседі. Заводта ол механикалық қоспалардан жеңіл еріген көмірсутектерді жою және электртұздардың құрғату құрылғыларынан қысқаша тазартудан өтеді.
Атмосфералық айдау. Мұнай ректифиацияланған колонналардан атмосфералық айдауға түседі.(айдау атмосфералық қысымда)
Ол жерже ол бірнеше фракцияларға бөлінеді.
Жеңіл ауыр бензиндік фракция, керосиндік фракция,дезильдік фракция және атмосфералық айдаудың қалдығы – мазут. Фракциялардан алынған сапа, мұнай өнімдеріне көрсетілген талаптарына сәйкес келмегендіктен, фракцияларды келесі өңдеуге жіберіледі.
Екіншілік процестер. Екіншілік процестердің мақсаттарының бірі өндірістегі моторлы отынның көлемін көбейту, олар көмірсутек молекуласының химиялық модификациясымен байланысты, әдетте олардың тотығуға ыңғайлы түрге айналады.
Екіншілік процестің бәрін бағыттары бойынша негізгі Екіншілік процестің бәрін бағыттары бойынша негізгі 3 топқа бөлуге болады:
- Тереңдетілген, каталитикалық крекинг, термиялық крекинг, висбрекинг,гидрокрекинг, жай кокстену, битумдарды өндіру;
- Басқалар: майларды өндіру процестері, МТБЭ алкилдеу, ароматты көмірсутектерді өндіру және т. Б
- Асылдандырылған:риформинг, гидротазарту, изомерлену және т.б
Каталитикалық риформинг – мұнай өнімдерін каталитикалық ароматтандыру.Риформингке қайнау температурасының шегі 85-180°С болатын бензиндік фракция ұшырайды. Реформинг нәтижесінде бензиндік фракция ароматикалық қосылыстармен қанығады және октандық саны шамамен 85 ке дейін көтеріледі. Алынған өнім (риформат) афтобензиндерді өндірудегі компонент ретінде және шикізаттан ароматикалық көмірсутектерді бөліп алуда қолданылады.
Гидротазарту – жоғары қысым және температура болғанда сутетің әсерімен заттардың химиялық айналу процесі. Мұнай фракцияларын гидротазарту (мұнай өнімдеріндегі күкірт) азайтуға бағытталған.Шексіз көмірсутектердің қанығуы, оттекті қосылыстардағы шайырды азайту, сонымен қатар өміртек молекуласының гидрокенгі қосымша жүреді. Мұнай өңдеудің ең кең тараған процесі. Гидротазартуға мұнайдың келесі фракциялары ұшырайды: бензиндік фракция, керосиндік фракция, моторлық майлар, вакуумды газоиль, дезильді отын.
Каталитикалық крекинг – жоғары октанды бензин компонентін және шексіз май газдарын алу мақсатымен жүргізілетін мұнай фракцияларын өңдейтін термокаталитикалық процесс. Каталитикалық крекинг шикізат ретінде атмосфералық және жеңіл вакуумды газоиль қолданылады. Отын шығаруда қолданылатын ауыр көмірсутектердің молекулаларының бөлінуі осы процестің міндеттерідің бірі болып табылады.Крекинг процесі кезінде көптеген майлы (пропан, бутан) газдар бөлінеді. Крекингтің негізгі өнімдері болып пентан – гександы фракция (газды бензин) және нафтакрекинг саналады, олар автобензин компоненттерінде пайдаланылады. Крекинг қалдығы мазуттың қалдығы болып саналады.
Гидрокрекинг – сутектің артуымен өтетін көміртегі молекулаларының бөліну процесі. Гидрокрекингтің шикізаты ретінде ауыр вакуумды газоиль (вакуумдық дестиляцияның орташа фракциясы) қолданады. Сутектің басты көзі ретінде риформинг қызмет атқарады. Гидрокрекингьің негізгі өнімі дезильді отын және гидрокрекинг бензині (автобензиннің толық компоненті) саналады.
Кокстау – оттектің қатысуынсыз сұйық және қатты отындарды өңдеу процесі. Отын бөлінгенде қатты өнім – кокс және ұшатын өнімдер түзіледі.
Изомерлену. Дұрыс құрылысты көмірсутектерден изокөмірсутектерді (изопептан, изогексан) алу процесін айтады. Процестің мақсаты болып химиялық мұнай өндіру үшін шикізатты алу (изопрен изопептаннан) және автомобильді бензиннен жоғары октанды компоненттерді алу болып саналады.
Алкилдеу – алкилді органикалық қосылыстың молекуласына енгізу.Әдетте алкилдеуші агенттерге алкилгалогендер, алкендер, спирттер, кейде альдегидтер, кетондар, эфирлер, дизолкандар, сульфидтер жатады.
Мұнай химиясы. Мұнай химиясы түсінігі бірнеше өзара байланысқан мағыналарды білдіреді: химия бөлімі мұнай көмірсутектерінінң айналуын зерттейтін химизм және табиғи газды пайдалы өнімдерге және шикізат материялына
Химиялық технология бөлімі.(екінші аты – химиялық мұнай синтезі). Өнеркәсіпте пайдаланылатын мұнай және табиғи газ өңдеуде қолдану ректификация, крекинг,риформинг, алкилдеу, изомерлеу, кокстау, пиролиз, дегидрлеу, гидрлеу, алмонолиз, тотығу, нитрлеу және т.б сипаттайтын технологиялық процестер.
Міндеттері: мұнай құрамының компонентерін қалыптастыру заңдылықтарын анықтау және дисперсті жүйенің мұнай құрылымын наықтау, мұнай қайтымының көбейтудегі дәстүрлі емес әдістің ғылыми негізін құру. Анализ және алынған технологияларды экологиялық бағалау және химиялық өнімді қолдану.
Коксохимиялық технология. Бұл өнеркәсіпте тнегізгі шикізат болып көмір саналады. Көмірдің құрылысы мен құрылымын микроскоп арқылы зерттеуге болады. Жай көзге көрінетін көмірдің құрылысы макроструктура деп аталады. Жай микроскоп көмірдің жіңішке құрылысын, яғни микроструктурасын көруге мүмкіндік береді.
Тас көмірді кокстау үшін пайдаланғанда оның техникалық құрамын, бірігуін, кок стануын, минералды қоспалардың көлемі бойынша көмір кластарына таралуы және көміршихталарының салмағын білу керек..
Отынның техникалық құрамы әдетте, отынның техникалық пайдалануын сипаттайтын мәліметтерді айтады. Көмірдің техникалық құрамы ылғалдың бар болуымен және минералды қоспалардың болуымен, ұшатын заттар шығуымен күкірт және фосфор болуымен, сонымен қатар, отынның жану жылулығымен анықталады.
Көмірді кокстауға дайындау. Алынатын кокстың сапасы ең алдымен көмірдің дайындалуы және көмір шихтасын дұрыс құруына байланысты. Коксохимиялық заводқа көмір әдетте көптеген шахталардан және көмір өндіретін фабрикалардан түседі және маман тек көмірдің қасиеті құрамын емес, сонымен қатар, олардан жақсы, сапалы кокс беретін қоспа дайындай білуі қажет. Кокстау үшін көмір шихтасын құрамын құру эмпирикалық түрде жүзеге асырылады. Кокстың сапасын анықтаудағы негізгі талаптардың бірі - жеткілікті көлемдегі жоғарғы беріктік. Сол себепті: көмір шихтасын коксты заттың жоғарғы беріктігін қамтамасыз ететін фактор ретінде уақытта жеткілікті болуы керек.
Алайда тым көп біріксе мысалы ПЖ көмірі және Г көмірі жоғары беріктігі бар кокс алынады бірақ майда, поралық, доменді балқытуға қажетсіз болады. Тым ұсақталған аөмір немесе шихта кокстанғанда үлкен кокс береді, бірақ берік емес, оңай езілетін және доменді, балқытуға қажетсіз болып табылады. Осыдан көмірдің шихтасы оптимальды мағынаға ие болуы қажет деген қорытынды шығады.
Сапалы көмір алу үшін көмірдің алғашқы дайындығын жүргізу керек. Көмірді кокстауға дайындау бірқатар технологиялық процестерге кіреді: тығыздау, кептіру, көмір құрамын орталау, байту, бөлшектеу.
Кокстауға көмірді дайындау схемасын таңдағанда ең алдымен жоғары сапалы көмірді алуға ұмтылған жөн. Кокстың сапасы ихта біртекті болған сайын жоғарылайды.Төмен бірігулікке жәнеұшатын заттардың шығуы аз мөлшерге ие көмір бөліктері басқа маркадағы көмірлерге қарағанда ұсақ бөлшектенуі қажет. Әсіресе, шихтаның минерализацияланған бөлшектері ұсақ езілуі қажет. Олар бірікпейді, сол себепті кокстау процесі кезінде кокстың сапасын төмендететін жарықтар пайда болады. Оның бәрі көмірдің бөлшектену схемасы ең алдымен көмір бөлшектерінің минералды қоспаладрдың таралу есебін ескере отырып таңдау қажет.
Кокс сапасына әсер ететін факторлардың бірі көмірдің бірігуі. Көмір шихталарының бірігуін жоғарылатудың әсерлі әдістерінің бірі – ол механикалық тығыздау. Ол үшін шихтаны арнайы металды қорапқа салады. Бұл қорапты коксты ошақтан шығаратын машинаға орналастырады. Қораптың қабырғалары жылжып, алынады. Көмір қабаттары қорапта арнайы механикалық трамбовкамен тығыздалады. Егер көмір 8 – 12% ылғылды болса, онда одан шашырамайтын қатты болк түзіледі. Кокстауға арналған қазіргі заманғы ошақтар отқа төзімді материалдан салынған, төтрбұрышты, көлденең камералардан тұрады. Ошақтың камералары жанындағы қабырғалары арқылы жылжиды. Ошақтар бір қатарға орналастырылады және жылу шығынын азайту үшін,жинақылыққа жету үшін батареяға бірігеді.
Ұзындығы 410 мм ошақ батареяларына әдетте 65 ошақ кіреді, ал ұзырдығы 450 мм, сыйымдылығы үлкен батареяға 77 ошақ кіреді. Әдеттегі камералар пайдалы көлемге ие. 20 – 21,6 м3 ғ ал сыйымдылығы жоғары ошақтар — 30 м3. Ошақтың 450 мм ден ұзындығы көп болса, кокстың сапасы нашарлайды
Негізгі әдебиеттер 2 [289-315], 4 [127-133]
Қосымша әдебиеттер 5 [89-100]
Бақылау сұрақтары
1. Органикалық шикізатты өңдеудің химиялық технологиясы
2. Біріншілік және екіншілік мұнай өңдеу процестері
3. Мұнайхимиясының пәні және міндеттері
4. Коксохимиялық технология
Лекция 14 Органикалық синтездің өндірісіндегі тотығу процестері. Тотығу технологиясының ерекшеліктері. Тотығу процесінің классификацифсы. Тотығу процесінің реакторлары.
Мұнай. Химиялық мұнай синтезі және негізгі органикалық өнеркәсібінде маңызды процестердің бірі — тотығу. Ол көптеген құнды өнім алуға мүмкіндік береді. Олар: карбон қышқылдары, нитрилдер, спирттер, альдегитдтер, кетондар және т. Б. Бұл өнімдердің көбісі аралық зат.(жартылай өнім) және ары қарай кең гаммалы органикалық өнімдерді алуға қатысады. Кең гаммалы органикалық өнімдерге: еріткіштер, дәрі дәрмектер, мономерлер, жуғыш заттар, синтетикалық полимерлер.
Тотығу процесіне көмірсутектердің айналуы немесе тотығу агенттерінің әсерімен органикалық заттарға айналуы жатады.Көп жағдайда тотығу нәтижесінде молекулаға бір немесе бірнеше атом оттегіге кіреді. Алайда, бұл тотығу реакцияларының жалпы белгісі емес, себебі молекуладағы оттегі атомының саны өзгермейтін тотығу процестері де бар:
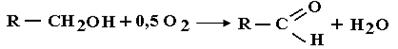
Одан басқа оттегіні молекулаға басқа реакциялар, мысалы гидротация немесе гидролиз арқылы енгізуге болады.
СН2 = СН2 + Н2О  Сн3 – Сн2Он
Сн3 – Сн2Он
СН3 – СН2 – Cl + Н2О  Сн3 – Сн2 – Он + НCl
Сн3 – Сн2 – Он + НCl
Бейорганикалық химияға қарағанда, органикалық тотығу реакциялары органикалық молекула атомдарының валенттілігінің өзгеруімен сипатталады.
Органикалық химияда тотығудың жалпы жалғыз бірдей белгісі ол, тотығуға ұшыраған көміртек атомы зарядының жоғарылауы. Мысалы, тотығу тіздегінде қаныққан көмірсутектің(алкан) заряды біртінбер тотығу мөлшеріне қарай жоғарылайды. -3 тен +4 ке дейі:.

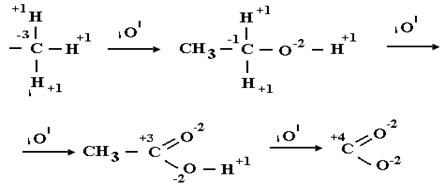
Бұл тізбектегі соңғы өнім карбон қышқылы. Оның кейінгі тотығуы, молекуласының бөлінуі, яғни СО2 мен Н2О түзілуіне әкеледі. Мұндай реакцияны жаңа тотығу деп атайды. Технологияда толық емес тотығу реакциясының орнының кез келген сатысында тоқтатып, керек аралық затты, тотығудың мақсатты өнімі ретінде алуға болады.
Тотығу технологиясының ерекшеліктері.
Технологиялық процестерде тотықтырғыш агент ретінде молекулярлы оттекті ауа немесе техникалық оттегі ретінде пайдаланылады, себебі оны арзан және шектелмеген көлемде алуға болады.
Қолдану масштабына байланысты екінінші тотықтандырғыш сұйытылған 40-60%-к ерітінді түрінде қолданылатын, азоттық қышқыл болып табылады.
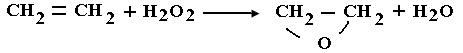
Жақында ғана технологияда тотықтырғыш агент ретінде асқын тотықты қосылыстар пайдаланыла бастады. Оларға: асқын тотықты сутек (30% - ды сулы ерітінді ретінде) немесе асқын сірке қышқылы Бұл тотықтандырғыш өте қымбат, сол себепті оларды сирек, тек азот қышқылымен және оттек әсерімен жүрмейтін реакцияларға ғана пайдаланылады.Мысалы олефин негізінде эпоксидті қосылыстарды алуда:
Тотығу процесінің ерекшеліктерінің бірі болып әдістері және тотығу реакцияларының көптігі санымен қатар өндірістің үлкен көлемі саналады. Сол себепті, өнімнің тотығу синтезінің технологиясында периодты процестер сирек қолданылады. Тотығу процестері органикалық синтез техеологиясында экзотермиялық процестерге жатады, жылу әсерінің мәні тотығу тереңдігі көбейген сайын жоғарылайды, әсіресе көмірсутектерден карбон қышқылы түзілгенде жоғары болады, ал парафиндер толық тотыққанда реакцияның жылдамдық әсері 1425 кДж/моль жетеді Сол себепті көмірсутекті шикізат ең жылу өндіргіш отын болып табылады. Алайда, Менделеев айтқандай, көмірсутектерді отын ретінде пайдалану рационалды емес, себебі химиялық өңдеу өнімдері салыстырмалы көп пайда әкеледі.
Тотығу процесінің классификациясы. Тотығу процесінің классификациясына жан жақты көзқарасты қарауға болады.
Алдымен тотығу катализаторлармен және онсыз жүзеге асырылады. Осыған байланысты процестерді каталитикалық және каталитикалық емес деп бөледі. Олардың ең біріншілері бос радикалды механизм бойынша жүреді және әдетте аралық жанама және соңғы тотығу өнімін қоспасы түзілуіме бітеді.
Каталитикалық процесс селективті болып келеді, себебі катализаторлар негізгі өнімнің тотығу жылдамдығын жанама реакцияларға қарағанда көбейтеді. Катализаторларды аңдау және әрбір процестің оптмальды жағжайын дайындау эмпириалды түрде жүреді, сондықтан әлі күнге дейін катализаторлардың жалпы әсері туралы теория жоқ. Тотығу реакцияларын сондай ақ бастапқы көмірсутек тізбегін бөлінусіз және бөлінумен өтетін деп бөлуге болады.
Одан басқа тотығу айналымдары, басқа химиялық процестер сияқты гомогенді, реагентте, катализаторда, суда ерітілген жағдайда және гетерогенді, катализатордың қатты қабаты, реагенттің газды ортасында жеке фаза ретінде шыққан жағдайда. Осы фазалардың алғашқысы сұйық фазалы, ал екіншісінен - парафаздық деп аталады.
Осы көрсетілген параметрлерін есепке ала отырып және өнеркәсіптегі барлық тотығу процесін қарастыру ыңғайлылығы үшін, 4 топқа бөледі:сұйық фазалы каталитикалық және каталитикалық емес, және парафаздық,сонымен қатар, катализаторсыз және катализатормен өтетін реакциялар. Жанасқан тотығу реакциялары бөлек топты құрайды.
Тотығу процесінің реакторлары.
Тотығу процесінің апаратуралық әрлендіруі ең алдымен реакциялық қоспа кандай жағдайда тұрғанымен байланысты: сұйық фазалы немесе парафазалы, себебі бұл процестердің жүргізу жағдайлары әртүрлі.
Сұйық фазалы тотығу төмен теапературада өтеді, әдетте, 1500С тан аспайды және ауаны баботирлеу жолымен жүзеге асады. Мұндай реакцияларға реактор ретінде диамерті 2-3 м ге жететін борботожды коллоналар пайдаланылады. Оларды кейбір жпғдайларда көлденең сүзгілі немесе қалпақты тарелкалармен секциялайды немесе каскадаға біріктіреді. Карбон қышқылы кәдімгі болатты коррозияласа, аппаратураны дайындау үшін алюминийй, титан және кейбір легирленген болаттарды пайдаланады.
Реакциялық жылуды көп көлшерлде шығару үшін колонналар шыдамд және ішкі сулы салқындағышпен қамтылған, жылуалмастырғышпен жабдықталған. Жылуды тағы бастапқы көміртекті булану есебінен шығару тиімді. Әйтеуір, жаңа қондырғыларда 1500С дан жоғары температурада жұмыс істейді. Реакциялық жылу есебінен буды өндіреді. 14 суретте а – шыдамды салқындатқышы мен периодты тотықтандырғыш реактор көрсетілген.
Бірлік борботожы коллоннада үзліксіз процесті жүргізу, келесі тотығуға тұрақты, мақсатты өнім алуы мүмкін. Бұл жағдайда тотыққан зат және ауа реактор түбіне түседі, ал өнімді жоғарыда таңдап алады.
(Сурет. 1, б).
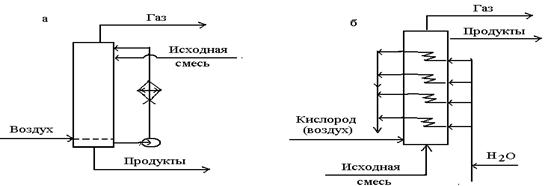
а – шыдамды салқындатқышы мен периодты әсері бар коллониаллы реактор;
б- ішкі салқындатқышымен үздікті әсері бар коллониаллы реактор;
қолданылады.(сурет 1, в) Ол сұйық реакционды массада кезекпен коллоннадан коллоннага ағады, ал ауа әрқайсысына бөлек түседі.Бұл жерде жылушығарғыш, яғни көмірсутек және еріткіш булану әдісі көрсетілген олардың буы әр коллоннаның үстінде тұратын теріс конденсаторларында конденсацияланады және конденсат реакторға ағып кетеді.
1, г суретінде үздіксіз әсер ететін реактордың бір түрі тарелкалық коллоннада көрсетілген. Мұнда сұйықтық жоғарыдан төмен қарай, яғни бір коллоннадан екіншіге ағып, ал ауа теріс ағынмен төменнен жоғары қарай жылжиды. Әрбір тарелкадағы сұйықтық бөлек тоңазытқыш арқылы айналып тұрса, шдамды салқындатқыш болуы мүмкін.
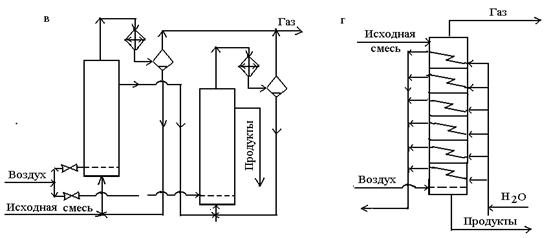
2 сурет. Молекулалы оттекті сұйықфазалы тотығудың реакциялық түйіні
в – булану есебінен салқынтайтын коллонна каскады;
г – тарелкалы коллонна;
Гетерогенді тотығудың булыфаза процесі сұйық фазалыққа қарағанда өте жоғары, 250-300 ден 400-5000С аралығында өзгеретін теапературада өтеді. Осыған байланысты көмірсутект оттегінің қоспасының жарылуға қауіптілігі артады. Жарылысты болдырмау үшін тотығуды таза ауа және сулы бу қосындылары бар рецикулирленген газдармен жүргізеді.
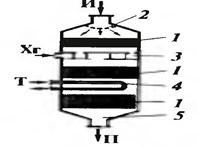
Тотығудың жоғары экзотермиялығына байланысты адиабетикалық реакторлар бұл процесте қолданысқа ие болмайды. Түтікті реактор түтігінде катализатордың стационарлы қабаты бар және түбірастындағы кеңістіктен өтетін салқын агент кеңінен таралған.(2 сурет).
Түтіктің диаметрі 10-25 мм,ол диаметр бойына температураның біртекті болуын қамтамасыз етеді. Мұндай түтіктің саны реакторлларда 100 ден 1000 ға дейін жетеді. Катализаторлық көлемді жақсы қолдану үшін, аппаратқа алдын ала жылытылған реагенттерді жібереді. Бөлінген жылуды шығарудың ең жақсы әдісі – ол сулы буды генерирлейтін, сулы конденсаттың түтік арасындағы булану. Кейде бөлек жылу тасымалдаушының салқындатуын пайдаланады, ол өз орнымен технологиялық бу беретін конденсатпен салқындайды.
Көптеген тотығу процестерінде барлық жері күйдірілген гетерогенді ктализаторы бар реакторы қолданылады. (сурет 15, б) Реагенттерді салқындатып жіберуге болады, ал катализаторды үнемі өлшеулі күйде болу керек болғандықтан, тығыз, микросфералық түрде қолданады.
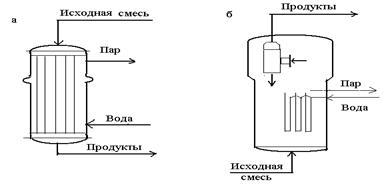
5- сурет.Гетерогенді каталитикалық тотығуға арналған реакторлар.
а- құбырлы аппарат стационарлы қабаты бар катализатормен;
б – күйген қабатты катализаторы бар аппарат.
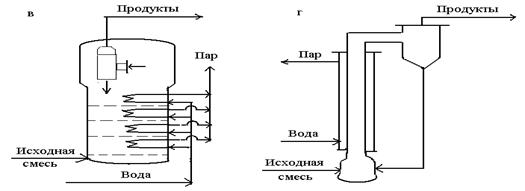
5- сурет. Гетерогенді каталитикалық тотығуға арналған реакторлар.
в –секционарлы қабаты бар күйген катализаторлы аппарат; г – өрлеу ағынды катализаторы бар аппарат.
Реактор бөлетін торшалармен, салқындатқыш құбырлармен, ұшқан газдарды бөліктермен сулайтын циклонмен жабдықталған. Мұндай аппаратта бірқалыпты температураны сақтау және жылушығарғыш мәселесі оңай шешіледі, бірақ процестің селективтілігін төмендететін теріс араластыру жүреді.
Соңғы кемшілікті жою үшін күйдірілген қабатты катализаторы бар секцияланған аппарат пайдаланылады. Теріс араластыруды азайту үшін тағы газбен бірге жоғары жылжитын өрлеу ағындары катализаторы бар реактор қолданылады. Реакциялық құбыр қайнаған сулы конденсаты бар жедемен салқындайды.
Барлық аталған аппараттарды каррозия болмау үшін легирленген болаттан жасайды.
Негізгі әдебиеттер 2 [289-315], 4 [127-133]
Қосымша әдебиеттер 5 [89-100]
Бақылау сұрақтары
1. Өнеркәсіптегі органикалық синтездің тотығу процестері деген не?
2. Тотығу технологиясының негізгі ерекшеліктері?
3. Тотығу процесінің классификациясына сипаттама беріңіз?
15 Көмірсутекті шикізаттың өнеркәсіптегі тотығу процестері. Сұйық фазадағы каталитикалық және каталитикалық емес процестер. Бұл фазадағы каталитикалық және каталитикалық емес процестер.
Каталитикалық емес сұйық фазадағы тотығу, бастапқы көмірсуиек сұйық немесе қажетті еріткіш ортасында гомогенді жапғдайда жүреді. Реакция тізбектің пайда болуы оның өсуі және ажырауы стадиясынан тұратын радикалды тізбекті механизмі арқылы жүзеге асады. Алдымен радикалдың алғашқы туындауы болады, яғни оттек және көміртек атомдарындағы бос валенттіліктің жоғары активтенуі радикалдар асқын тотықты және гидро асқын тотықты. Инициаторлар реакциялық қоспаға ең аз көлемде қосылатын қосылыстардың бұзылуынан түзіледі және тағы көмірсутек жағдайында өте аз сатыда өтетін термиялық автототығу реациясы есебінен жүреді.
Тізбектің түзілуі
R'–O O – R'  2 R'O• инициатордың бұзылуы
2 R'O• инициатордың бұзылуы
RH + O2  R• + HOO• автототығу
R• + HOO• автототығу
Тізбектің өсуі
R• + O2  ROO•
ROO•
ROO• + RH  ROOН + R•
ROOН + R•
R'O• + RH  R'OН + R•
R'OН + R•
Тізбектің ажырауы
2ROO•  ROOR + О2 диспропорциондалған
ROOR + О2 диспропорциондалған
R• + R• R – R рекомбинация
R – R рекомбинация
Каталитикалық емес сұйық фаза процесі алкан тотығуында өте сирек қолданылады. Реакция төмен силективті болғандықтан, ауыр бөлінентін өнімдердің араласуына әкеледі. Нормаларды алкан негізінде екіншілік спиртті алуда қолданады. Башкиров реакциясы ғана.Бор қышқылын қосқандықтан тотығудың селективтілігі жоғарылайды. Бор қышқыл әрі қарай тотықпайтын борат формасында түзілетін спирттерді реттейді. Бұл ппроцесс өнеркәсіп масштабында жүзеге асырылады:
 СН3 – (СН2)n – CH3 + O2
СН3 – (СН2)n – CH3 + O2 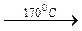 CH3(CH2)n-1 – CH – O – B
CH3(CH2)n-1 – CH – O – B
HBO3 \
CH3
Алғашқы сатысы кумолдан асқын тотыққа тотығу болып табылатын үлкен тоннажды фенол өндірісі процесінің сұйық фазадағы каталитикалық емес тотығу өндірісінде маңызы зор.
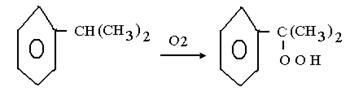
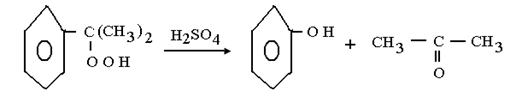
Тотығуды сұйық кумол ортасында 100-1300С теапературасында жүргізіледі. Онда түзілетін асқын оттектің концентрациясы кумол ерітіндісінде 20-30 % тен аспауы керек. Кейін артық кумолды булап, қайта тотықтырады. Ал өнімді нәтижесінде фенол мен ацетон түзілетін қышқылды бөлінудің 2- ші сатысына жібереді.
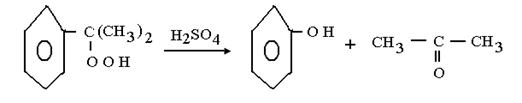
Бұл екі өнім химиялық өндірісте кеңінен қолданылады.Сулық фазадағы каталитикалық тотығу әдетте еріткіш сәйкес келетін ерітіндіде гомогенді процесс ретінде жүргізіледі немесе онсыз жүреді катализатор ретінде, әртүрлі металдың ерігіш тұздарын пайдаланады. Қазіргі уақытта осы типтегі процестердің өптеген түрі дайындалған.
Сұйық фазадағы тотығудың жаңа процестер қатарына этиленді ауа оттегімен тіке тотықтыру жолымен ацетальдегид алу жатады. Бұл процесс Кучеров реакциясы бойынша ацетилен негізінде өнеркәсіптегі ацеталбдегид синтезі көнерген әдістің орнын басты. Кучеров реакциясы экологиялық себептерге, яғни қолданылатын сынап катализаторының жоғары улылығына байланысты қолданыстан шықты. Жаңа процесте хлористы паллади мен этилен комплексі бөлінуінің нәтижесінде ацетиальдегид түзіледі. Бұл 3 сатылы ауыр процесті мына теңдеумен көрсетуге болады.
Сұйық фазадағы каталитикалық тотығу процесінде тағы ароматты қышқылдар (бензой, изофталевтік, терефталевтік). Ароматты көмірсутектерден (толуол, м - және п -ксилол) алуға болады.Әдетте процесті сірке қышқылы ерітіндісінде кобальт тұздары немесе аралас кобальт – марганец катализатор қатысымен жүргізеді.
Аароматты дикарбонды қышқылдар бастапқы өнім ретінде поликонденсациялау реакциясында қолданылады. Поликондкенсациялау реакциясы термотұрақты талшқтармен пленканы, яғни полиэтилен терофлатат ("лавсан", "терилен") және ароматты полиальдегидтер – фенилон және кевлар синтездеу үшін қажет. Соңғысы оқ өткізбейтін желет және каска өндіруде пайдаланады.
Булы фазадағы каталитикалық емес тотығу шикізат табиғатына байланысты теаператураны кең интервалда жылытатын ағынды реакторлардың газды формасында жүргізеді. Осы жолмен төмен алкандардың және бензиннің жеңіл фракцияларының тотығуы мүмкін. Мысалы, мұнайдың алғашқы өңдеу процесінде түзілетін, мұнай газдарын жағу арқылы алынатын, проан – бутанды қоспаның толық емес тотығуы АҚШ та жүргізіледі. Осылай, бір қатар өнімді алады:формалбдегид, ацетальдегид, метанол,н– бутанол,изобутанол, сірке қышқылы. Бұл процесті 3700С температурада және аз қысымда (7-8мм с.б)жүргізеді.
Булы фазадағы каталитикалық емес тотығудың басқа өнеркәсіптік әдісі – метанның (табиғи газ) белгілі мөлшердегі оттегімен толвық емес тотығу жолымен синтез – газды(СО және Н2 қоспасы) алу. Тотығудың тереңдігін реттеу үшін оттекті сулы бумен сұйылтады.Метанолды алу процесінде синтез– газ шикізат болып табылады. синтез– газ құрамындағы көміртек оксидін бөліп, олефиннен альдегид алу үшін оксосинтез процесінде қолданады. Булы фазадағы каталитикалық тотығу көптеген органикалық заттарды алудағы, қазіргі заманғы өнеркәсіптік процесс болып табылады. Ондай процестің көбісі үздіксіз және гетерогенді жағдайында ерімейтін металдар немесе олардың оксидінің қоспаларының қатты катализаторларын қолдану арқылы жүргізіледі.
Бұл типтің маңызы реакциясы болып этиленнің окмидке тікелей тотығуы табылды. Бұл процесті тағы эпоксидирлеу деп аталады:
|


Процесс газды формада, яғни күміс металын гетерогенді катализатор ретінде қолдау арқылы жүзеге асады. Тотықтырғыш агенттер: ауа және оттек 230-2900С теапературасында және 10-30 атм қысымда 50-70 %. Этилен тотығы түзіледі. Алынған өнімнің үлкен бөлігі полиэтилентерефталатты (лавсан талшығы, пленка, ПЭТ-шыны) синтезіндегі антифриз немесе мономер ретінде пайдаланылатын этиленглиеольды алуда жұмсалады.
Булы фазадағы каталитикалық тотығу процесі сонымен қатар, ди және тетракарбон қышқылының ангидридінің синтезі үшін үлкен практикалық қолданысқа ие. Ангидриттердің жоғары термотұрақтылығы жоғары температурада жақсы шығынмен және селективтілігімен жүргізуге мүмкіндік береді, ондай ангидридтерге фталевті (шикізаты – нафталин немесе о- ксилол), малеинді (шикізаті – бензол, бутилен, бутан), пиромелитті (тетраметилбензой негізінде алынады) және т.б жатады. Көрсетілген ангидридтер мен бояушы өнімдер, термотұрақты пленка және талшық алудағы поликонденсация реакциясында пайдаланылатын құнды мономері болып табылады.
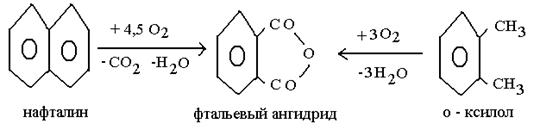
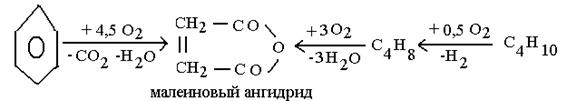
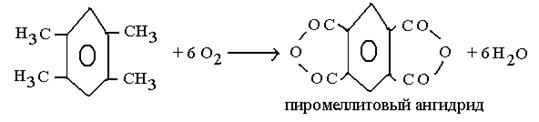
Бұл процестердің гетерогенді катализаторы болып басқа металдар оксиді және тұздар қосындысымен модифицирленген ванадий пентоксиді(V2О5) табылады.
Түйіскен тотығу процестер. Таза тотығу процесінен басқа қазіргі уақытта мұнай химиясы өнеркәсібінде тотығу процесіне тікелей қатсы жоқ ғ басқа реакциялармен тотығу реакцияларының түйісу (яғни бірге өтуі) әдістері дайындалған. Осындай процестердің бірі – пропилен негізіндегі аммиак қатысымен бу фазадағы каталитикалық тотығуға ұшырайтын акрилонитрилдің өнеркәсіптік синтезі:
СН2 = СН – СН3 + NH3 + O2  СН2 = СН – СN + 3H2O
СН2 = СН – СN + 3H2O
Бұл реакция тотығатын аммонолиз деген атау алды және үлкен тоннажды өндірісте жүзеге асырылады, себебі акрилонитрил мономер ретінде сұранысқа ие. Оның полимерленуі жүннің синтетикалқ орын басушысы болатын «нитрон» талшығын өндіретін полимерлі өнім алуға және термотұрақты материалдарды өндіруде қолданылатын "қара орлон" карбондалған талшығын алуға мүмкіндік береді.
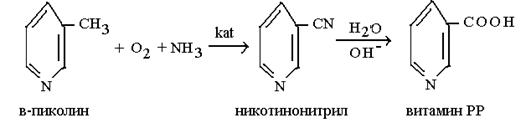
β - метилпиридиннің (β - пиколин) аммонолиз тотығу реакциясы Қазаөстандық химиктермен (академики Рафиков С.Р., Суворов Б.В., Сембаев Д.Х.) РР витаминінің бастапқы өнімі – никатинонитрилді алудағы өнеркәсіптік процесін пайындау үшін пайдаланған. Бұл реакция о -ксилол қолданысында жоғары өнімділікпен флодинитрил алуға мүмкіндік береді.
Түйіскен тотығу реакциясының басқа маңызды түрінің бірі – жуғыш ұнтақ және жуғыш заттар алатын, алкансульфоқышқылын алуға мүмкіндік беретін тотығудың сульфирлеу реакциясы:
RH + SO2 + 0,5 O2  R – SO3H
R – SO3H
Осы реакция тобына хлорлы тотығу реакциясы да жатады. Бұл реакцияның негізі – реакция барысында хлорға тотығатын хлорлы сутекті хлорлаушы агент ретінде пайдалануы:
С6Н6 + НСI + 0,5 O2  С6Н5СI + Н2О
С6Н5СI + Н2О
Бұл әдіс полимеризациясында полихлорвинил беретін, хлорлы винил- мономер өндірісінде де жоғары мағынаға ие болды. Ол көптеген құрылыс материалдары үшін ірі тоннажды шикізат болып келеді:
СН2= СН2 + 2НСI + 0,5 O2  СН2= СНСI + Н2О
СН2= СНСI + Н2О
Түйіскен тотығу реакцияларының қатарына булы фазада жүзеге асатын алкан және моноалкандар базасында диен өндірісінің дегирлену тотығуы жатады:
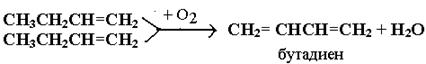
Алғаш Лебедевпен алынған каучук өндірісінің шикізаты – бутадиен, мұнай крекингінің бутилен фракциясынан түзіледі. Тотығу – дегирлеу реакциясының негізіне ванилацетат алынатын сірке қышқылы ерітіндісінде этиленнің түйіскен тотығу жаңа өнеркәісіптік процесі жатады:
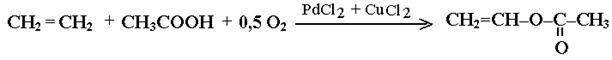
Винилацетат- сулы эмуьциялық бояуына және желімге шикізат болатын поливинилацетатқа келетін полимеризацияланатын құнды мономер
Біз қарастырған тотығу реакциясының түрлері өнеркәсіпте пайдаланатын органикалық заттардың әртүрлі класының синтезі, солекулаға тек оттек атомын емес, сонымен қатар күірт, азот, және т.б элементтерді енгізуге мүмкіндік береді.
Негігзі әдебиеттер 2 [289-315], 4 [127-133]
Қосымша әдебиеттер 5 [89-100]
Бақылау сұрақтары
1. Көмірсутек шикізатының өнеркәсіптік тотығу прцестерін атаңыз?
2. Сұйық фазадағы каталитикалық және каталитикалық емес процестер дегеніміз не?
3. Булы фазадағы каталитикалық және каталитикалық емес процестері және түйіскен тотығу процесі дегеніміз не?
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3811; Нарушение авторских прав?; Мы поможем в написании вашей работы!