
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Постулаты Бора. Теория одноэлектронного атома Бора
Ядерная модель атома в сочетании с классической физикой и электродинамикой оказалась неспособной объяснить устойчивость атомов и характер атомного спектра. Выход из создавшегося тупика был предложен в 1913г. учеником Резерфорда датским ученым физиком Нильсом Бором. Он сохранил ядерную модель атома Резерфорда, наделив её новыми квантовыми свойствами, согласно которым электрон мог бы, вращаясь вокруг ядра, испускать свет и не падать на ядро. Для этого Бору пришлось ввести предположения, противоречащие классической механике и электродинамике, доказать которые он был не в состоянии и назвал их постулатами.
Первый постулат Бора (постулат стационарных состояний):
электрон в атоме может находится только в некоторых определенных устойчивых состояниях, которые называются стационарными. В стационарном состоянии атом не излучает и не поглощает энергию. Стационарным состояниям соответствуют стационарные орбиты электронов, для которых момент импульса электрона равен целому кратному от  :
:
 – правило квантования орбит,
– правило квантования орбит,
где  - масса электрона,
- масса электрона,  - скорость электрона на орбите радиуса
- скорость электрона на орбите радиуса  ,
, 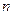 - номер орбиты электрона,
- номер орбиты электрона,  - постоянная Планка.
- постоянная Планка.
Второй постулат Бора (правило частот):
при переходе атома из одного стационарного состояния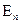 в другое
в другое 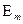 происходит излучение или поглощение кванта с энергией
происходит излучение или поглощение кванта с энергией
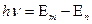 .
.
Следовательно, атомы поглощают только те спектральные линии (волны такой частоты), которые сами испускают:
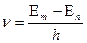 .
.
Постулаты Бора можно сформулировать и несколько проще.
1. электроны в атоме движутся по строго определенным стационарным орбитам, не излучая и не поглощая при этом энергии; для стационарных орбит
 , (
, ( ).
).
2. При переходе электрона с одной орбиты на другую атом излучает или поглощает энергию
 ,
,
где  - энергия фотона;
- энергия фотона;  и
и  - энергии электрона на соответствующих орбитах.
- энергии электрона на соответствующих орбитах.
Постулаты Бора позволили ему теоретически рассчитать энергетический спектр атома водорода и водородоподобных атомов – атомов, состоящих из ядра с зарядом 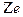 и одного электрона, движущегося вокруг ядра.
и одного электрона, движущегося вокруг ядра.
Рассчитаем радиусы стационарных орбит для водородоподобных атомов.
При движении электрона по орбите в поле атомного ядра с зарядом  согласно 2-му закону Ньютона
согласно 2-му закону Ньютона  ,
,  .
.
Согласно постулату Бора

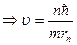 ,
,

 .
.
Если электрон находится на самой внутренней орбите (n=1), атом находится в нормальном состоянии, все остальные состояния – возбужденные.
Для атома водорода 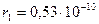 м, что совпадает со значением размеров атома водорода, полученных из кинетической теории газов.
м, что совпадает со значением размеров атома водорода, полученных из кинетической теории газов.
Рассчитаем энергии стационарных состояний. энергия электрона складывается из кинетической энергии его движения по орбите и потенциальной энергии в электростатическом поле ядра:
 ,
,
 ,
,
 (n=1,2,3,….),
(n=1,2,3,….),
где знак минус означает, что электрон находится в связанном состоянии.
Из полученного выражения следует, что полная энергия электрона в водородоподобном атоме отрицательна и зависит от номера орбиты, по которой движется электрон, т.е. может принимать только дискретные значения.
 При n=1
При n=1 
Т.к. полная энергия отрицательна, то чем меньше её абсолютное значение, тем больше значение полной энергии. Следовательно, с ростом n энергия увеличивается.
При 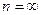
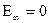 .
.
это и есть максимальное значение энергии системы, состоящей из ядра и одного электрона. Если электрону сообщить извне порцию энергии 13,55 эВ, то он уйдет с первой орбиты за пределы атома, а атом превратится в положительный ион. этот процесс отщепления электрона от атома называется ионизацией. Ионизация – это отщепление электронов от атомов, приводящее к образованию положительных ионов.
Величину энергии электрона в атоме часто отождествляют с энергией атома. Все возможные значения энергии атома, которыми он может обладать, называют энергетическими уровнями. Энергетические уровни атома изображают в виде горизонтальных прямых, расположенных друг относительно друга на расстояниях, пропорциональных разности энергий атома. Самая низшая прямая соответствует нормальному состоянию атома.
|
|
Дата добавления: 2014-01-04; Просмотров: 1491; Нарушение авторских прав?; Мы поможем в написании вашей работы!