
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика элементов VII А группы периодической системы Д. И. Менделеева
 |
Лекция № 9
Тема «Галогены»
План:
1) Общая характеристика элементов VII А группы периодической системы Д. И. Менделеева.
2) Распространение в природе и физические свойства галогенов
3) Хлор, способы получения, химические свойства.
4) Кислородные соединения хлора.
5) Галогеноводороды. Качественные реакции на хлорид, бромид и иодид-ионы.
К галогенам относятся элементы 7А группы - фтор 9F, хлор 17Cl, бром 35Br, йод 53I, астат 85At.
Первые четыре элемента встречаются в природе в виде соединений, астат получен только искусственным путем и неустойчив (радиоактивен, недостаточно изучен).
Строение внешней электронной оболочки … пs2 np5.
Галогены относятся к p - элементам.
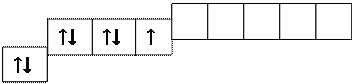
Атомы галогенов имеют на внешнем энергетическом уровне семь электронов. Распределение электронов внешнего энергетического уровня в основном состоянии:
 |
np5
пs2
Так как у атомов галогенов на внешнем электронном слое имеется один
неспаренный электрон, для них характерная валентность I.
Кроме фтора, у атомов всех галогенов в возбужденном состоянии может увеличиваться число неспаренных электронов, поэтому галогены в соединениях могут проявлять валентность III, V, VII.
Например, у атома хлора возможны три возбужденных состояния со следующими электронными конфигурациями:
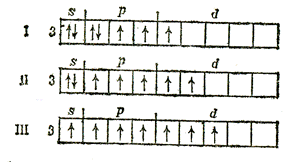 Cl*
Cl*
Cl**
Cl***
В соединениях с водородом и металлами галогены проявляют характерную степень окисления -1. Данная степень окисления является низшей для галогенов, поэтому ионы галогенов (кроме F-) способны отдавать электрон и поэтому являются только восстановителями.
Восстановительная способность галогенид-ионов увеличивается в ряду: Cl- → Br- → I-
Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительные степени окисления +1, +3, +5, +7.
|
|
|
HCl- HCl+1O HCl+3O2 HCl+5O3 HCl+7O4
В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к электрону (радиусы галогенов приближаются к таковым инертных газов)
Сверху вниз в подгруппе с ростом порядкового номера
· радиус атома ↑
· неметаллические свойства ↓
· электроотрицательность ↓
· окислительные свойства ↓
· восстановительные свойства ↑
В свободном состоянии галогены существуют в виде двух атомных молекул, атомы галогенов связаны друг с другом ковалентной полярной связью.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 4392; Нарушение авторских прав?; Мы поможем в написании вашей работы!