
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика гетерогенных химических реакций
|
|
|
|
Гетерогенные реакции – это химические реакции, протекающие на границе раздела фаз (чаще всего раствор/твердая фаза или газ/твердая фаза) в тонком диффузном слое.
Рассмотрим гетерогенный процесс на границе твердая фаза - жидкая фаза. В этом случае можно выделить следующие основные стадии:
1) подвод исходных веществ из объема раствора к поверхности раздела фаз;
2) протекание химической реакции в тонком диффузном слое;
3) отвод продуктов реакции вглубь раствора.
Ограничимся рассмотрением случая, когда перенос вещества осуществляется только за счет диффузии - переноса вещества, обусловленного неравенством химических потенциалов компонентов внутри системы (вызванного разностью концентраций веществ в системе). В процессе диффузии вещество переходит из области с большей концентрацией в область с меньшей концентрацией (процесс направлен в сторону уменьшения химического потенциала вещества).
Процессы диффузии в заданном направлении с кинетической точки зрения описываются законом Фика: количество вещества dn, проходящее за время dt через площадь поверхности S, прямо пропорционально градиенту концентрации вещества dC/dx в растворе:
 , (6)
, (6)
где dС - разность концентраций вещества в точках, отстоящих друг от друга на расстояние dх, т. е. на толщину диффузионного слоя.
Коэффициент пропорциональности D называют коэффициентом диффузии, он равен количеству вещества, прошедшего за единицу времени через единицу площади поверхности при градиенте концентрации, равном единице. Знак “минус” ставится потому, что диффузия направлена от большей концентрации к меньшей.
Коэффициент диффузии увеличивается с повышением температуры по закону, аналогичному уравнению Аррениуса:
|
|
|
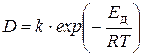 , (7)
, (7)
где Е д - энергия активации процесса диффузии, редко превышающая величину в 4-10 кДж/моль, т. е. во много раз меньше энергий активации большинства химических реакций.
Рассмотрим процесс растворения твердого тела. Концентрация вещества меняется в диффузионном слое от значения СV (концентрации вещества в объеме раствора) до значения СS (концентрации вещества в приповерхностном слое). Скорость растворения твердых тел определяется скоростью диффузии растворяемого вещества из поверхностного слоя в жидкую фазу
 , (8)
, (8)
где β = (D · S)/(V δ) - константа скорости диффузии или константа массопередачи, δ – толщина диффузионного слоя.
Скорость процесса диффузии прямо пропорциональна разности концентраций вещества в объеме раствора и приповерхностном слое.
Рассмотрим мономолекулярную реакцию А → В, протекающую в гетерогенных условиях. С течением времени в системе при определенной температуре устанавливается стационарное (не изменяющееся во времени) состояние, при котором скорости собственно химической реакции (w 1), диффузии исходного вещества из объема раствора в поверхностный слой (w 2) и химической реакции в целом (w) (т. е. скорости образования вещества В) становятся равными:
w =  = w 1 = w 2. (9)
= w 1 = w 2. (9)
Скорость химической реакции w 1 зависит от концентрации вещества А на поверхности раздела фаз (CS) и согласно основному постулату химической кинетики определяется выражением:
w 1 = k·CS. (10)
где k - константа скорости собственно химической реакции.
Скорость диффузии будет определяться соотношением:
w 2 = b · (CV – CS).
Тогда
b · (CV – CS) = k × CS
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!