
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Используя метод стационарных концентраций можно записать
|
|
|
|
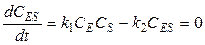
k 1 CECS = k 2 CES + k 3 CES
Следовательно
 (14)
(14)
Уравнение материального баланса по ферменту:
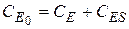
Следовательно, текущая концентрация фермента будет:

Подставим СЕ в уравнение (14)
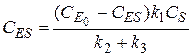 (15)
(15)
Выразим из уравнения (15) концентрацию ферментно-субстратного комплекса ES
(k 2 + k 3) CES = k 1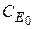 CS - k 1 CESCS
CS - k 1 CESCS
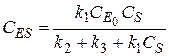
Делим числитель и знаменатель на k 1 CS. Получим:
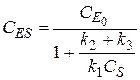 .
.
Обозначим

где kM - константа Михаэлиса.
Окончательно для скорости ферментативной реакции:
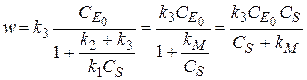
Когда CS «kM, скорость образования продукта прямо пропорциональна CS. Если CS» kM, то скорость образования продукта не зависит от CS и имеет максимальную величину
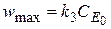 .
.
Физический смысл этого уравнения заключается в том, что при больших концентрациях исходного вещества весь катализатор входит в состав промежуточного соединения ES. Концентрация ES достигает предельного значения 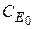 . Следовательно и скорость получения продукта достигает предельной для данного количества катализатора величины, обозначаемой w max.
. Следовательно и скорость получения продукта достигает предельной для данного количества катализатора величины, обозначаемой w max.
Гетерогенный катализ.
Гетерогенный катализ имеет исключительно большое значение в современной химической промышленности, по некоторым оценкам до 70% химических продуктов производится с использованием гетерогенно-каталитических процессов. В качестве примеров можно привести синтез серной кислоты, основанный на каталитическом окислении оксида серы (IV) SO2 в оксид серы (VI) SO3 на платиново-ванадиевых катализаторах (Pt, V2O5); синтез аммиака из водорода и азота на железных катализаторах, промотированных оксидами калия, алюминия; окисление аммиака в оксиды азота на платиновых катализаторах (производство азотной кислоты) и другие.
Так как при гетерогенном катализе катализатор представляет собой отдельную фазу и каталитические процессы происходят на его поверхности (границе раздела фаз), то огромную роль в протекании гетерогенно-каталитических реакций играют процессы массопереноса. Для них характерны все те особенности, которые рассматривались при изучении гетерогенных химических реакций, т.е. процесс может лимитироваться одной из стадий и происходит в диффузионной, кинетической или переходной области. В настоящее время считается твердо установленным, что каталитическое действие происходит через стадию химического взаимодействия реагирующих веществ с поверхностью катализатора или с отдельными ее участками, получившими название активных центров. Роль активных центров часто играют выступы и ребра на поверхности кристаллической фазы катализатора, дефекты кристаллической структуры и т.д.
|
|
|
В общем случае гетерогенно-каталитические процессы можно условно разбить на следующие стадии:
1. диффузия исходных веществ из раствора или газовой фазы к поверхности катализатора,
2. адсорбция молекул исходных веществ на активных центрах катализатора,
3. собственно химическая реакция между адсорбированными молекулами,
4. десорбция продуктов реакции с поверхности катализатора,
5. отвод продуктов реакции вглубь раствора или газовой фазы.
Поскольку гетерогенно-каталитические реакции происходят между адсорбированными на активных центрах молекулами, то в уравнение скорости таких реакций входят поверхностные концентрации реагирующих веществ. Так, например, гидрирование этилена на медном катализаторе происходит между адсорбированными молекулами этилена и водорода:
С2Н4 (адс.) + Н2 (адс.) = С2Н6,
а скорость этой реакции пропорциональна произведению поверхностных концентраций:
w = k ·[С2Н4 (адс.)]·[Н2 (адс.)].
Существование активных центров следует из такого экспериментального факта как отравление катализатора чрезвычайно малым количеством ядов, которое может полностью подавить активность катализатора.
|
|
|
Основными современными теориями гетерогенного катализа являются мультиплетная теория и теория активных ансамблей.
Мультиплетная теория. Согласно этой теории активный центр - это совокупность нескольких адсорбционных центров на поверхности катализатора. При адсорбции реагирующих молекул на активном центре образуется мультиплетный комплекс, благодаря чему перераспределяются связи и образуются продукты реакции. Адсорбция протекает согласно принципам геометрического и энергетического соответствия.
Сущность геометрического соответствия состоит в том, что расположение силовых центров в мультиплете должно соответствовать расположению атомов в адсорбируемой молекуле.
Согласно принципу энергетического соответствия, оптимальный состав катализатора отвечает условию равенства энергии образования и разрушения мультиплетного комплекса. Слишком слабые и слишком сильные взаимодействия реагирующих веществ с катализатором нежелательны.
Теория активных ансамблей. В соответствии с данной теорией каталитический процесс происходит на группе атомов, называемых активным ансамблем. В отличие от мультиплетной теории, атомы активного ансамбля не являются элементами кристаллической решетки катализатора и могут свободно мигрировать в пределах определенной области поверхности катализатора. Миграция ограничена потенциальными барьерами, возникающими за счет микроскопических трещин, наличия примесей, неоднородности твердой поверхности.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 486; Нарушение авторских прав?; Мы поможем в написании вашей работы!