
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример расчета
|
|
|
|
Составить материальный баланс реактора каталитического окисления метанола в формальдегид. Производительность реактора по формальдегиду 10 000 т/год. Степень превращения метанола в формальдегид - 0,7; общая степень превращения метанола (с учетом побочных реакций) - 0,8. Содержание метанола в спирто-воздушной смеси - 40% по объему. Мольные соотношения побочных продуктов на выходе из реактора
НСООН: СО2: СО: СН4 = 1,8: 1,6: 0,1: 0,3.
Аппарат работает 341 день в году с учетом времени ППР (планово-предупредительных ремонтов) и простоев.
Решение: Формальдегид получается в результате окисления паров метанола кислородом воздуха при температуре 550—600°С на серебряном катализаторе, где протекают следующие реакции:
СН3ОН + 1/2О2 = СН3О + Н2О, (1)
СН3ОН = СН20 + Н2, (2)
СН3ОН = СО + 2Н2, (3)
СН3ОН + Н2 = СН4 + Н2О, (4)
СН3ОН+О2 = НСООН+ Н2О, (5)
СН3ОН + 1,5О2 = СО2 + 2Н2О. (6)
Возможная реакция Н2 + 1/2О2 = Н2О стехиометрически зависима, так как она в сумме с реакцией (2) дает реакцию (1), поэтому ее нужно из балансовых расчетов исключить.
На реакцию подается лишь около 80% воздуха от мольного соотношения метанол: кислород = 2: 1 и процесс проводится с неполным сгоранием водорода, образующегося по реакции (3).
Отходящие газы содержат 20-21 % формальдегида, 36-38% азота и примеси в виде СО, СО2, СН4, СН3ОН, НСООН и др. Вся эта смесь после охлаждения в котле-утилизаторе и холодильнике до 600 С подается в поглотительную башню, орошаемую водой. Полученный раствор формалина содержит 10-12% метанола, который в данном случае является желательной примесью, так как препятствует полимеризации формальдегида. Молекулярные массы: формалина - 30; метанола - 32; кислорода - 16.
Производительность реактора по формальдегиду
10 000 • 1000/341/24= 1220 кг/ч или 1220/30 = 40,7 кмоль/ч.
Так как по реакциям (1) и (2) на образование 1 моля формальдегида расходуется 1 моль метанола, то, при 70% степени превращения метанола в формальдегид, имеем расход метанола в этом случае
40,7/0,7 = 58,12 кмоль/ч или 58,12 • 32 = 1860 кг/ч.
Определим объемные расходы исходных веществ при нормальных условиях.
Метанол - 58,12 • 22,4 = 1300 м3/ч.
Спирто-воздушная смесь - 1300/0,4 = 3250 м3/ч.
Воздух - 3250 - 1300 = 1950 м3/ч, в нем:
кислорода - 1950 • 0,21 =410 м3/ч или 410 • 32/22,4 = 586 кг/ч;
азота - 1950 • 0,79 = 1540 м3/ч или 1540 • 28/22,4 = 1920 кг/ч.
Определим расход метанола, пошедшего на образование побочных продуктов по реакциям (3) - (6). При общей степени превращения метанола 80% имеем расход метанола по побочным реакциям
58,12 • (0,8 - 0,7) = 5,81 кмоль/ч.
Не прореагировало метанола 58,12 • 0,2 = 11,6 кмоль/ч или 11,6• 32 = 372 кг/ч.
Сумма долей побочных продуктов 1,8 + 1,6 + 0,1 + 0,3 = 3,8.
Тогда расходы побочных продуктов в отходящих газах будут равны:
Уксусная кислота (НСООН) - 5,8 • 1,8/3,8 = 2,75 кмоль/ч или 2,75 • 46 = = 126,5 кг/ч.
Диоксид углерода (СО2) - 5,8 • 1,6/3,8 = 2,45 кмоль/ч или 2,45 • 44 = 108,0 кг/ч.
Оксид углерода (СО) - 5,8 • 0,1/3,8 = 0,158 кмоль/ч или 0,158 • 28 = 4,3 кг/ч.
Метан (СН4) - 5,8 • 0,3/3,8 = 0,459 кмоль/ч или 0,459 • 16 = 7,3 кг/ч.
Для определения расходов водяного пара и водорода составим баланс по кислороду и водороду. В реактор поступает кислорода:
с воздухом - 586 кг/ч;
в составе метанола - 1860 • 16/32 = 930 кг/ч.
Всего: 586 + 930 = 1516 кг/ч.
Расходуется кислорода:
на образование формальдегида - 1220 • 16/30 = 650 кг/ч;
на образование НСООН - 126,5 • 32/46 = 88 кг/ч;
на образование СО2 - 108 • 32/44 = 78,6 кг/ч;
на образование СО - 4,3 • 16/28 = 2,45 кг/ч;
в составе не прореагировавшего метанола - 372 • 16/32 = 186 кг/ч.
Всего: 1005 кг/ч.
Остальное количество кислорода, равное 1516 - 1005 = 509 кг/ч, пошло на образование воды по реакциям (1), (4), (5) и (6). В результате расход воды равен - 509 18/16 = 572 кг/ч.
В реактор поступает водорода - 1860 • 4/32 = 233 кг/ч.
Водород расходуется:
на образование СН2О - 1220 • 22/30 = 81,5 кг/ч;
на образование НСООН - 126,5 • 2/46 = 5,5 кг/ч;
на образование СН4 - 7,3 • 4/16 = 1,82 кг/ч;
на образование Н2О - 572 • 2/18 = 63,6 кг/ч;
в составе не прореагировавшего газа - 372 • 4/32 = 46,5 кг/ч.
Всего: 198,9 кг/ч.
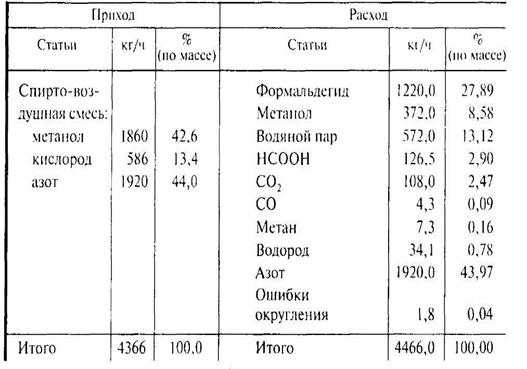
Количество водорода в свободном состоянии — 233 - 198,9 = 34,1 кг/ч. Результаты расчета сведены в таблице материального баланса.
Таблица – Материальный баланс процесса получения формальдегида
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 4039; Нарушение авторских прав?; Мы поможем в написании вашей работы!