
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
Для оксосоединений характерны следующие типы реакций:
1.1. Нуклеофильное присоединение (AN).
1.2. Электрофильное замещение (SЕ).
1.3. Окисление.
1.4. Восстановление.
1.1. Реакции нуклеофильного присоединения.
Разрыв π-связи С=О и присоединение, в первую очередь, нуклеофильной (отрицательно заряженной частицы) к атому углерода оксогруппы.
Реакционная способность оксосоединений в реакциях АN.
Основное правило:
Чем выше положительный заряд на атоме углерода оксогруппы, тем более реакционноспособно соединение.
Влияние строения углеводородного радикала на реакционную способность оксосоединений в реакциях AN:
1. Альдегиды более реакционноспособны чем кетоны.
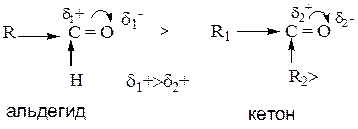
2. С увеличением длины цепи реакционная способность соединения снижается.
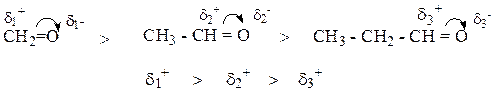
3. С увеличением объема радикала реакционная способность соединения снижается.

4. Чем ближе разветвление к оксогруппе тем ниже реакционная способность соединения.

5. Акцепторы увеличивают реакционную способность, доноры - снижают.

6. Ароматические оксосоединения менее реакционноспособны, чем алифатические. Это объясняется сопряжением, возникающим между оксогруппой и бензольным кольцом.

1.1.1. Реакция с синильной кислотой (HCN).
Протекает в щелочной среде с образованием оксинитрилов; в реакцию вступают все оксосоединения,

Механизм реакции:
1. Образование нуклеофильной частицы.

2. Образование аниона.
Π-связь в оксогруппе разрывается, нуклеофил присоединяется к углероду, а на кислороде оксогруппы образуется отрицательный заряд.

3. Образование конечного продукта.
При дальнейшем взаимодействии с водой, протон присоединятся а кислороду, образуя оксинитрил.

Пример:


1.1.2. Реакция с гидросульфитом (бисульфитом) натрия (NaHSO3).
В данную реакцию вступают все альдегиды и метил кетоны. Продуктом реакции является гидросульфитное производное.
Метилкетоны – это оксосоединения,в которых метильная группа (СН3-) соединена с атомом углерода оксогруппы.
Пример:


Пример:
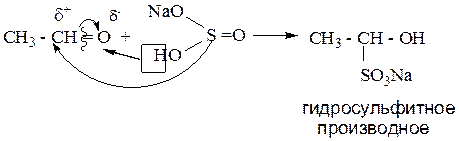

1.1.3. Реакция со спиртом.
Данная реакция характерна только для альдегидов. Протекает в 2 стадии, в кислой среде, до образования ацеталя.

Пример:

1.1.4. Реакции с азотсодержащими соединениями (аммиаком, гидразином, гидроксиламином).
Данные реакции протекают по общему механизму:
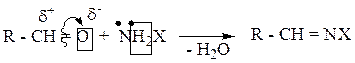
1. Присоединение молекулы азотсодержащего соединения с образованием биполярного иона. В оксосоединении происходит разрыв π-связи, молекула азотсодержащего соединения, имея на азоте неподеленную электронную пару, присоединяется к атому углерода. На кислороде образуется избыток электронной плотности (отрицательный заряд), на азоте – недостаток электронной плотности (положительный заряд).

2. Далее, происходит перегруппировка: протон переходит к кислороду, образуя неустойчивый аминоспирт.

3. Далее, происходит отщепление воды, с образованием конечного продукта.
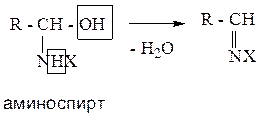
Правильнее эту группу реакций следует отнести к реакциям «присоединения-отщепления».
1.1.4.1. Реакция с гидразином (NH2-NH2).
Характерна для всех оксосоединений, конечный продукт реакции - гидразин. Частный случай данной реакции – взаимодействие с фенилгидразином (С6Н5-NHNH2).

Пример:


1.1.4.2. Реакция с гидроксиламином (NH2OH).
Реакция характерна для всех оксосоединений. Конечным продуктом реакции является оксим.

Пример:


1.1.4.3. Реакция с аммиаком.
Данная реакция характерна только для альдегидов, продуктом реакции является имин. Кетоны реагируют с аммиаком в более жестких условиях и образуют сложные продукты.
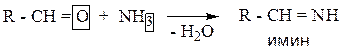
Пример:

1.1.5. Взаимодействие оксосоединений с реактивом Гриньяра (магнийорганическим соединением).
Данный способ позволяет получить все типы спиртов (от первичных до третичных), протекает в две стадии, через образование смешанной соли. Используя в качестве исходного продукта: метаналь, - получают первичный спирт; альдегид, отличный от метаналя, – приводит к образованию вторичного спирта; кетон - образует третичный спирт.

Пример:

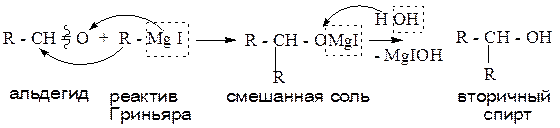
Пример:


Пример:
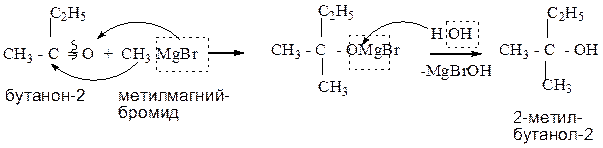
1.1.6.Реакция с пятихлористым фосфором.
Данная реакция, так же, относится к реакциям смешанного типа (присоединение с последующим отщеплением). Приводит к образованию дигалогенопроизводных оксосоединений.

Пример:


1.2. Реакции электрофильного замещения (реакции на подвижный водород в α-положении.
1.2.1.Реакция галогенирования.
В результате реакции образуются α-галоенозамещенные оксосоединения.

Пример:
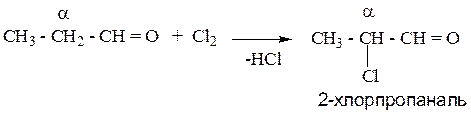

1.2.2. Альдольно - кротоновая конденсация.
Данный синтез протекает в щелочной среде с образованием альдолей, затем, непредельных оксосоединений. В зависимости от строения соединений реакция протекает в одну или две стадии. Для соединения, у которого разрывается π-связь, реакция протекает по механизму AN, а для того соединения, которое отдает подвижный водород – по механизму SE. Если в реакции участвуют два различных соединения, π-связь разрывается у соединения, более реакционноспособного в реакциях АN. (см. п.1.1).
Механизм реакции.

1. Образование аниона.
В щелочной среде, в молекуле менее реакционноспособного в реакциях АN соединения, происходит отщепление протона, с образованием аниона.

2. Образование аниона.
Альдоль – соединение, имеющее в своем составе окси- и оксогруппу.
В другом оксосоединении π-связь разрывается и анион направляется к углероду; на кислороде, при разрыве π-связи образуется избыток электронной плотности (отрицательный заряд).

3. Образование альдоля.
Альдоль – соединение, имеющее в своем составе окси- и оксогруппу. При взаимодействии с водой, происходит присоединение протона с образованием альдоля.

4. Образование непредельного оксосоединения.
Если у α-углеродного атома альдоля есть в наличии водород, происходит отщепление воды с образованием непредельного оксосоединения. Если подвижного водорода нет – данная стадия отсутствует.

Пример 1:

Пример 2:

Пример 3:

Вторая стадия в данном синтезе невозможна, т.к. в α-положении нет водорода.
1.3. Окисление оксосоединений.
1.3.1.Окисление альдегидов.
1.3.1.1. Реакция с реактивом Толленса («серебряного зеркала»).
В данной реакции происходит окисление альдегида до карбоновой кислоты. Реакция относится к типу окислительно–восстановительных. Альдегид окисляется, серебро восстанавливается.

Пример:

1.3.1.2. Реакция с реактивом Феллинга.
В данной реакции происходит окисление альдегида до карбоновой кислоты. Реакция относится к типу окислительно – восстановительных. Альдегид окисляется, медь восстанавливается.

Пример:

1.3.2. Окисление кетонов.
Окисление кетонов приводит к образованию смеси карбоновых кислот и кетонов.
Пример1:
Если у кетона нет разветвлений в α-положении, образуется смесь карбоновых кислот.

Пример 2:
Если у кетона есть разветвления в α-положении, наряду с кислотами, образуются кетоны.
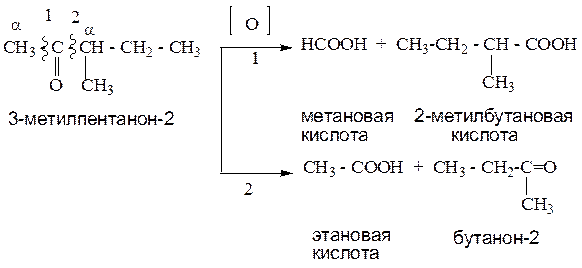
1.4. Восстановление оксосоединений.
При восстановлении альдегидов образуются первичные спирты, кетонов – вторичные. Реакция протекает в присутствии катализатора (Ni, Pd, Pt).

Пример:

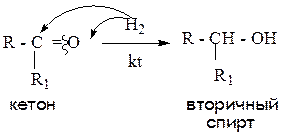
Пример:

|
|
Дата добавления: 2014-01-04; Просмотров: 2796; Нарушение авторских прав?; Мы поможем в написании вашей работы!