
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення кальцинованої, харчової та каустичної соди та їх сумішей
|
|
|
|
Якість препарату соди визначаеться відсотковим вмістом чистого Na2,C03 (домішками е NaCI, Na2S04, NaOH, гігроскопічна вода). Для цього наважку кальцинованої соди розчиняють у воді і титрують 0,1 н розчином соляної кислоти. При цьому послідовно перебігають такі реакції:
Na2CO3 + НCl = NaHCO3 + NaCI (1)
NаHCOз + HCl = H2CO3 + NаCl (2)
―――――――――――――――――
Na2CO3 + 2НCl = H2CO3 +2 NaCI (3)
Розглянемо криву титрування соди. Для 0,1н розчину Na2C03 знаходимо pH, користуючись формулою для середніх солей багатоосновних кислот:
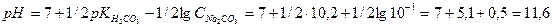
Під час першої стадії титрування утворюеться буферний розчин, тому зміна pH відбуваеться досить повільно.
В першій точці еквівалентності утворюеться кисла сіль, pHрозчину якої розраховуемо за відповідною формулою:
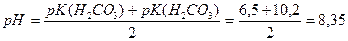
Після першої точки еквівалентності знову утворюються буферні розчини Н2СО3 - NaHC03, і крива титрування має пологий характер. Друга точка еквівалентності відповіае pH, який розраховуемо за формулою для слабких кислот:

Оскільки Н2СОз нестійка, вона більшою частиною розкладаеться нa СО2 і Н2О. Показано, що у випадку вихідної концентрації NaHCО3 рівної 0,1моль/л концентрація Н2СО3 = 5·10-2 моль/л. Отже
pH= 1/2·6,5 - 1/2(0,7 - 2) = 3,25 + 0,65 = 3,9
За цими даними побудуемо криву титрування. З неї видно, що для фіксації першої точки еквівалентності найбільш придатним є індикатор фенол-фталеїн ( pH = 8 - 10, рТ = 9), а другої метилоранж ( pH = 3 - 5, рТ=4) .
.
Розрахунок вмісту Na2CO3 у технічній соді розраховуемо за формулами:
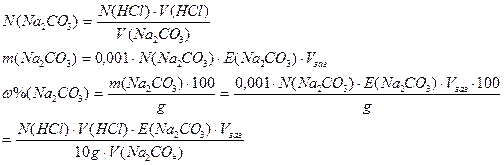
Зрозуміло, що у розрахункову формулу при титруванні підставляють - при титруванні по фенол-фталеїну Е(Na2C03) = М(Na,C03)/1 = 106 г/моль, а при титруванні по метилоранжу - Е(Na2C03) = М(Na2CО3)/2 = 53 г/моль.
Визначення Na2C03 і NaHCO3 в суміщі доводиться робити, наприклад, при оцінці якості харчової соди, ступеня кальцинації гідрокарбонату натрію у содовому виробництві.
|
|
|
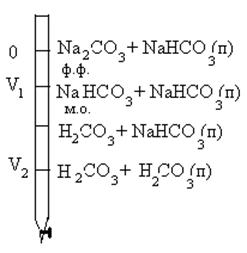 Титрування обов'язково проводять за двома індикаторами. Нехай об'ем HCl при титруванні по фенолфталеїну складе V1, а по метилоранжу V2. Зі схеми видно, об'ем HCI, який пішов нa титрування гідрокарбонату, який був у розчині спочатку, дорівнює V2 - 2V1, а маса його в суміші розраховуеться за формулами:
Титрування обов'язково проводять за двома індикаторами. Нехай об'ем HCl при титруванні по фенолфталеїну складе V1, а по метилоранжу V2. Зі схеми видно, об'ем HCI, який пішов нa титрування гідрокарбонату, який був у розчині спочатку, дорівнює V2 - 2V1, а маса його в суміші розраховуеться за формулами:

Визначення Na2CO3 і NaOH є суміші має значення при контролі чистоти препаратів їдкого лугу і в деяких інших випадках. При титруванні суміші за ф.ф. відбуваеться нейтралізація всього NaOH і Ha половину Na2C03:
NaOH + HCl = NaCI + Н2О
Na2CO3 + HCl= NaHCО3 + NaCl
 Нехай нa ці процеси піде V1 HCl.
Нехай нa ці процеси піде V1 HCl.
Друга точка еквівалентності за м.о. наступить після повної нейтралізації розчину:
NаHCOз + HCl =Na2CO3 + NаCl
і об'ем HCl складе V2.
З діаграми видно, що нa титрування половини Na2CO3 пішов об'ем HCl (V2 - V1). Тоді для визначення тільки лугу затрачено НС1
V2 - 2(V2 – V1) = V2 - 2V2 + 2V1 = 2V1 – V2
Для обчислення вмісту каустичної і кальцинованої соди користуемось відомими формулами, приймаючи Е(NaOH)=56г/моль, Е(Na2CО3)=106/2= 53г/моль.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 559; Нарушение авторских прав?; Мы поможем в написании вашей работы!