
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Залежність редоксипотенціалів від концентрації реагуючих речовин, температури і кислотності середовища. Рівняння В.Нернста
|
|
|
|
При розгляді реакцій окиснення-відновлення необхідно мати на увазі наступні особливості редокс - потенціалу.
1.) Значення Е0 відносяться не до елементу, не до речовини, а до певної системи, тобто до певної реакції, яка супроводжується зміною ступенів окислення. Так, наприклад, не можна говорити про Е0 заліза взагалі, оскільки для реакції Fe3+ +e = Fe2+ E0 =0,77B один, для реакції Fe2+ +2е = Fe0 E0 = -0,44 В другий, а для прямого переходу Fe3+ +3е = Fe0 E0 = -0,04 В третій.
2.) Значення Е0 відноситься до певних умов середовища, у якому відбувається реакція. Наприклад (див. діаграму) у кислому середовищі для рівноваги Sn4+ +2e = Sn2+ E0= +0,15B і відповідні властивості проявляє слабо. Той же валентний перехід при 1М концентрації гідроксоіонів дорівнює E0 = -0,96 В. І, дійсно, ми переконувались не раз у якісному аналізі, що Na2SnO3 y лужному середовищі є сильним відновником.
3.) При зміні співвідношення концентрацій окисно-відновний потенціал також міняється. Очевидно, що чим вищій відносний вміст окисненої форми, тим вищі Е, а чим вища концентрація його відновленої форми, тим нижче значення Е. Окисний потенціал, який характеризує систему при перебігу О.В.Р. (поточний потенціал) позначимо Е х. Його значення можна обрахувати, користуючись формулою Нернста, яка виведена на основі законів термодинаміки:
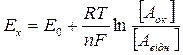 , де
, де
R – універсальна газова стала;
Т – температура, К;
F – число Фарадея, 96500 кул.;
n – кількість електронів, що приймають участь у реакції.
Підставляючи значення F і T =303 (30о) і вводячи коефіцієнт переходу від натуральних до десяткових логарифмів, одержуємо дещо спрощену формулу Нернста:
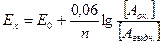 ,
,
якою і користуються на практиці.
Цією формулою звичайно користуються для розрахунку впливу концентрації реагуючих іонів на окисно-відновний потенціал. У випадку, коли реакція іде з безпосередньою участю іонів водню, концентрація останніх фігурує у рівнянні Нернста. Наприклад, для процесу
|
|
|

Якщо один із компонентів системи нерозчинний, то редокс-потенціал відноситься (у присутності надлишку твердої фази) до насиченого розчину, концентрація якого постійна і тому не входить в рівняння Нернста. Так для процесу 
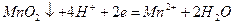
вираз має значення
 .
.
Вплив концентрації водневих іонів очевидний, наприклад, на перебіг реакції, на якій базується йодометричне визначення миш’яку:
 (4)
(4)
Розглянемо дві електронно-іонні напівреакції:
а) 

 (5)
(5)
б) 
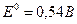 (6)
(6)
Окисно-відновні потенціали системи (6) в досить широких межах не залежить від рН розчину. Між тим в реакції (5) відбувається не тільки приєднання двох електронів, але й зв’язування одного атома кисню для переводу арсенат – в арсеніт-іони. Отже,
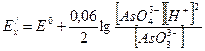 ,
,
і при 1М концентрації усіх компонентів маємо

Цей потенціал дещо вищій, ніж для системи (6), але він стає ще вищім при більшому підкисленні розчину, тому в цих умовах  виділяє
виділяє  із КІ.
із КІ.
(Наприклад,  10 моль/л, рН =1,
10 моль/л, рН =1, 
При пониженні кислотності, наприклад, до нейтральної (при рН = 7) і різних концентраціях  і
і  .
.
 моль/л
моль/л

Тепер потенціал системи 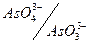 став меншим
став меншим 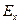 системи
системи 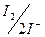 тому у нейтральному або слабо лужному середовищі арсеніти можна титрувати розчином йоду, практично йде зворотна реакція. Таким чином, регулюючи величини рН розчину, можна визначити арсен в обох його валентних формах.
тому у нейтральному або слабо лужному середовищі арсеніти можна титрувати розчином йоду, практично йде зворотна реакція. Таким чином, регулюючи величини рН розчину, можна визначити арсен в обох його валентних формах.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 824; Нарушение авторских прав?; Мы поможем в написании вашей работы!