
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
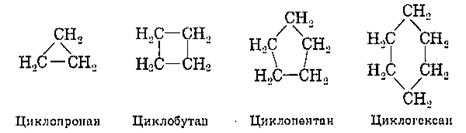
Циклоалкани
|
|
|
|
Адорно Т.В.
…Саме ім’я діалектика говорить спочатку лише про те, що в її поняттях предмети не виникають, що вони суперечать загальноприйнятій нормі adaequatio. Суперечність – це зовсім не те, у що був зобов’язаний перетворити суперечність гегелівський абсолютний ідеалізм, суперечність не є гераклітівське істотне. Суперечність – знак неістинності тотожності, знак виникнення досягнутого в понятті. Видимість тотожності внутрішньо притаманна мисленню в силу самої його чистої форми. Мислити – значить ідентифікувати, визначати, встановлювати тотожність.
…Діалектика – це послідовне логічне усвідомлення нетотожності. Вона не створює підстави для концепції. До діалектики думку штовхає її недостатність, якої не уникнути, погрішності в мислимім. Якщо обернути проти діалектики докори, які повторюються з часів аристотелівських критиків Гегеля, то все, що попадає на млин такої критики, зводиться до чисто логічної форми суперечності і залишає без уваги безкінечне різнобарв’я неконтрадикторного, просто суперечливого; таким чином погрішності речі перекладаються на метод.
Адорно Т.В.Негативна діалектика.
3. НЕНАСИЧЕНІ ВУГЛЕВОДНІ
Ненасичені вуглеводні – це група органічних сполук, в яких між атомами Карбону утворюються кратні зв’язки. Ненасичені вуглеводні можна поділити на такі класи:

3.1.АЛКЕНИ або ЕТИЛЕНОВІ ВУГЛЕВОДНІ
АЛКЕНАМИ або етиленовими вуглеводнями називають органічні сполуки, в яких між атомами Карбону утворюється один подвійний зв’язок.
Наприклад, С = С –С – С – С.
Ознаки гомологічного ряду алкенів або етиленових вуглеводнів:
1) тип гібридизації - sp2 , що вказує на утворення одного подвійного зв’язку між атомами Карбону; подвійний зв’язок складається з одного π-зв’язку (менш міцного) та одного σ- зв’язку (міцного);
|
|
|
2) валентний кут (α) між атомами Карбону за місцем подвійного зв’язку дорівнює 1200; α = 120°;
3) відстань (ι) між атомами Карбону за місцем подвійного зв’язку дорівнює 0,134нм; ι = 0,134 нм;
4) найпростіша молекула алкенів – етен (етилен) має плоску будову;
5) загальна формула алкенів:
СnH2n
6) назва алкенів утворюється при додаванні до числівника закінчення
~ ен (~ илен);
7) гомологічний ряд алкенів або етиленових вуглеводнів:
Кількість атомів Карбону Формула Назва
n = 1 СН2 мет + ен = метен (метилен) не існує
n = 2 С2Н4 ет + ен = етен (етилен)
n = 3 С3Н6 проп + ен = пропен (пропілен)
n = 4 С4Н8 бут + ен = бутен (бутилен)
n = 5 С5Н10 пент + ен = пентен (пентилен)
n = 6 С6Н12 гекс + ен = гексен (гексилен)
n = 7 С7Н14 гепт + ен = гептен (гептилен)
n = 8 С8Н16 окт + ен = октен (октилен)
n = 9 С9Н18 нон + ен = нонен (нонилен)
n = 10 С10Н20 дек + ен = декен (декилен)
Міжнародна номенклатура алкенів або етиленових вуглеводнів
Для того, щоб назвати алкен, який має розгалужену будову необхідно користуватись такими правилами:
1) Карбоновий ланцюг нумеруємо з того боку, де ближче розташований подвійний зв’язок;
2) вказуємо розташування радикалів, називаємо їх;
3) вказуємо номер атома Карбону, з якого починається подвійний зв’язок;
4) називаємо довжину карбонового ланцюга алкену.
ВЛАСТИВОСТІ АЛКЕНІВ або ЕТИЛЕНОВИХ ВУГЛЕВОДНІВ
Фізичні властивості
Алкени трапляються в природі у значно менших кількостях, ніж алкани. Вони містяться як домішки у деяких родовищах нафти та природного газу. Багато природних сполук складної будови є похідними алкенів.
Перші чотири сполуки гомологічного ряду алкенів (С1 – С4) за звичайних умов – гази, не мають запаху; наступні одинадцять (С5 –С15) – рідини, а решта (від С16 і т.д.) – тверді речовини без запаху. Алкени не розчинні у воді, але розчиняються в органічних розчинниках (хлороформі, бензені, етері), легші за воду.
|
|
|
Із збільшенням молекулярної маси алкенів зростають густина, температури кипіння та плавлення. Алкени з розгалуженою будовою мають нижчі температури плавлення порівняно зі сполуками з нерозгалуженою будовою молекул. Це загальне правило для всіх органічних сполук пояснюють тим, що сполуки нормальної будови мають щільну упаковку кристала. Щоб його зруйнувати (розплавити), потрібно затратити більшу енергію, отже, й температура плавлення має бути вищою:
Етен (етилен) – безбарвний газ, майже без запаху, трохи легший за повітря, мало розчинний у воді, добре розчиняється в естері, спирті, має слабку наркотичну дію.
Хімічні властивості
Алкени виявляють більшу хімічну активність, ніж алкани та циклоалкани. Це зумовлено наявністю в їхніх молекулах подвійного зв’язку, який включає один σ - зв’язок - міцний та один π - зв’язок – менш міцний.
π - зв’язок через меншу міцність стає активним, легко розривається, вивільняючи електрони (валентності атомів Карбону) та приєднує різні речовини. Тому найхарактернішими реакціями алкенів є реакції приєднання водню, галогенів, галогеноводнів, води, повного окиснення, часткового окиснення, полімеризації та ізомеризації.
1. Приєднання водню – РЕАКЦІЯ ГІДРУВАННЯ – при взаємодії алкенів з воднем π – зв’язок розривається, а на місце вільних валентностей атомів Карбону приєднуються атоми Гідрогену:
АЛКЕН + Н2 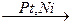 АЛКАН
АЛКАН
СН2 = СН2 + Н2  СН3 – СН3
СН3 – СН3
Ет ен (ет илен) Ет ан
2. Приєднання галогенів (F2, CI2, Br2, J2) – ГАЛОГЕНУВАННЯ – при взаємодії алкенів з галогенами π – зв’язок розривається, а на місце вільних валентностей атомів Карбону приєднуються атоми галогену, утворюючи
дигалогенопохідне алкенів або етиленових вуглеводнів:
АЛКЕН + Hal2  ДИГАЛОГЕНОПОХІДНЕ АЛКАНУ ДИГАЛОГЕНОПОХІДНЕ АЛКАНУ
|
СН2 = СН2 + СІ2  СН2СІ – СН2СІ
СН2СІ – СН2СІ
Ет ен (ет илен) 1,2 - дихлороет ан
3. Приєднання НF, НCI, НBr, НJ – ГІДРОГЕНГАЛОГЕНУВАННЯ – при взаємодії
алкенів з гідрогенгалогенами π – зв’язок розривається, а на місце однієї вільної валентності атома Карбону приєднується атом Гідрогену, на місце другої вільної валентності атома Карбону приєднується атом Галогену, утворюючи галогенопохідне алкенів або етиленових вуглеводнів.Реакція приєднання відбувається за правилом Марковнікова:
|
|
|
Атом Гідрогену приєднується до більш гідрогенізованого атома Карбону, а атом Галогену – до менш гідрогенізованого атома Карбону.
АЛКЕН + НHal 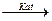 ГАЛОГЕНОПОХІДНЕ АЛКАНУ
ГАЛОГЕНОПОХІДНЕ АЛКАНУ
СН2 = СН2 + НСІ  СН3 – СН2СІ
СН3 – СН2СІ
Ет ен (ет илен) Хлороет ан
4. Приєднання води – ГІДРАТАЦІЯ – при взаємодії алкенів з водою (формулу Н2О записуємо як Н – ОН) π – зв’язок розривається, а на місце однієї вільної валентності атома Карбону приєднується атом Гідрогену, на місце другої вільної валентності атома Карбону приєднується група ОН, утворюючи одноатомні спирти.Реакція приєднання відбувається також за правилом Марковнікова:
АЛКЕН + Н - ОН  СПИРТ
СПИРТ
СН2 = СН2 + Н – ОН  СН3 – СН2ОН
СН3 – СН2ОН
Ет ен (ет илен) Ет анол
5. Повне окиснення:
| АЛКЕН + О2 → СО2↑ + Н2О |
6. ПОЛІМЕРИЗАЦІЯ. Молекули алкенів можуть сполучатися одна з одною. Це відбувається внаслідок розриву π – зв’язків між атомами Карбону. У результаті реакції утворюються дуже довгі молекули з великим числом атомів. Речовину, що складається з таких молекул, називають полімером, вихідну сполуку – мономером, а реакцію утворення полімеру з мономера – полімеризацією. З етилену (етену) С2Н4 добувають поліетилен (-СН2 – СН2 -)n, пропілену (пропену) С3Н6 – поліпропілен (-СН(СН3) – СН3 -)n. Полімеризація відбувається за наявності каталізатора (кислоти). Наприклад:
n CH2 = CH2 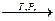 (– CH2 – CH2 –)n
(– CH2 – CH2 –)n
Етен (етилен) Поліетилен
7. ЯКІСНІ РЕАКЦІЇ НА ПОДВІЙНИЙ ЗВ’ЯЗОК
Для того, щоб визначити алкени серед інших органічних сполук використовують такі якісні реакції:
а) Часткове окиснення – ЗА ДОПОМОГОЮ КАЛІЙ ПЕРМАНГАНАТУ (KMnO4) – при додаванні до алкенів KMnO4 рожеве забарвлення зникає, тому що відбувається реакція приєднання:
3 СН2 = СН2 + 2 KMnO4 + 4 H2O  3 CH2 – CH2 + 2 MnO2 + 2 KOH
3 CH2 – CH2 + 2 MnO2 + 2 KOH
Етен | |
(етилен) ОН ОН
1, 2 – етандіол
(етиленгліколь)
б) ВЗАЄМОДІЯ З БРОМНОЮ ВОДОЮ (Br2) – при додаванні бромної води її жовте забарвлення зникає, тому що відбувається реакція приєднання:
|
|
|
СН2 = СН2 + Br2  СН2Br – СН2Br
СН2Br – СН2Br
Етен Дибромоетан
ДОБУВАННЯ АЛКЕНІВ або ЕТИЛЕНОВИХ ВУГЛЕВОДНІВ
І. ЛАБОРАТОРНІ МЕТОДИ.
1. При нагріванні спиртів в присутності концентрованої сульфатної кислоти відщеплюється молекула води та утворюється алкен:
Н Н
| |
Н – С – С – Н  СН2 = СН2 + Н2О
СН2 = СН2 + Н2О
| |
Н ОН
2. При нагріванні галогенопохідних алканів з розчином лугу та спирту:
СН3 – СН2 – СН2 – СІ + NaOH  CH3 – CH = CH2 + NaCI + H2O.
CH3 – CH = CH2 + NaCI + H2O.
3. З дигалогенопохідних:
СН2 – СН2 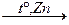 СН2 = СН2 + ZnBr2
СН2 = СН2 + ZnBr2
| |
Br Br
ІІ. ПРОМИСЛОВІ МЕТОДИ.
1. У промисловості алкени добувають дегідруванням алканів (відщеплення водню):
Н Н
| |
Н – С – С – Н  СН2 = СН2 + Н2 ↑
СН2 = СН2 + Н2 ↑
| |
Н Н
ЗАСТОСУВАННЯ АЛКЕНІВ або ЕТИЛЕНОВИХ ВУГЛЕВОДНІВ
Серед алкенів найбільше використовують етен (етилен) і пропен (пропілен) для добування полімерів (пластмас).
Етен витрачають на виробництво етилового спирту та етилен гліколю, який використовується як компонент охолоджувальної суміші в автомобільних двигунах.
Рідкі алкени є основою лаків, фарб, засобів боротьби з шкідниками рослин (дихлороетан – СН2СІ – СН2СІ) і хворобами тварин, деяких лікарських препаратів (хлороетан – СН3 – СН2СІ – анестезійна речовина).
Етен (етилен) прискорює дозрівання плодів, тому що цю речовину виділяють фрукти та овочі при достиганні (0,08 мл етилену для достигання 1 кг помідорів протягом 24 годин).
Етилен є сировино. Для одержання синтетичного каучуку.
3.2. АЛКІНИ (АЛКИНИ) або АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ
АЛКІНАМИ або ацетиленовими вуглеводнями називають органічні сполуки, в яких між атомами Карбону утворюється один потрійний зв’язок.
Наприклад, С ≡ С –С – С – С.
Ознаки гомологічного ряду алкінів або ацетиленових вуглеводнів:
1) тип гібридизації - sp , що вказує на утворення одного потрійного зв’язку між атомами Карбону; потрійний зв’язок складається з двох π-зв’язків (менш міцних) та одного σ- зв’язку (міцного);
2) валентний кут (α) між атомами Карбону за місцем потрійного зв’язку дорівнює 1800; α = 180°;
3) відстань (ι) між атомами Карбону за місцем потрійного зв’язку дорівнює 0,120нм; ι = 0,120 нм;
4) найпростіша молекула алкінів – етин або етін (ацетилен) має лінійну будову;
5) загальна формула алкінів:
СnH2n-2
6) назва алкінів утворюється при додаванні до числівника закінчення
~ ін або ~ ин (~илин);
7) гомологічний ряд алкінів або ацетиленових вуглеводнів:
Кількість атомів Карбону Формула Назва
n = 1 СН мет + ин = метин (метилин) не існує
n = 2 С2Н2 ет + ин = етин (етилин)
n = 3 С3Н4 проп + ін = пропін (пропілин)
n = 4 С4Н6 бут + ин = бутин (бутилин)
n = 5 С5Н8 пент + ин = пентин (пентилин)
n = 6 С6Н10 гекс + ин = гексин (гексилин)
n = 7 С7Н12 гепт + ин = гептин (гептилин)
n = 8 С8Н14 окт + ин = октин (октилин)
n = 9 С9Н16 нон + ин = нонин (нонилин)
n = 10 С10Н18 дек + ин = декин (декилин)
Міжнародна номенклатура алкінів або ацетиленових вуглеводнів
Для того, щоб назвати алкін, який має розгалужену будову необхідно користуватись такими правилами:
1) Карбоновий ланцюг нумеруємо з того боку, де ближче розташований потрійний зв’язок;
2) вказуємо розташування радикалів, називаємо їх;
3) вказуємо номер атома Карбону, з якого починається потрійний зв’язок;
4) називаємо довжину карбонового ланцюга алкіну.
ВЛАСТИВОСТІ АЛКІНІВ або АЦЕТИЛЕНОВИХ ВУГЛЕВОДНІВ
Фізичні властивості
У природі алкіни (ацетиленові вуглеводні) не трапляються через високу хімічну активність молекул.
Перші чотири сполуки гомологічного ряду алкінів (С1 – С4) за звичайних умов – гази, не мають запаху; наступні одинадцять (С5 –С16) – рідини, а решта (від С16 і т.д.) – тверді речовини. Алкіни не розчинні у воді, але розчиняються в органічних розчинниках, легші за воду.
Із збільшенням молекулярної маси алкінів зростають густина, температури кипіння та плавлення:
Найважливіший серед алкінів – етин – АЦЕТИЛЕН – газ майже без запаху, мало розчинний у воді, трохи легший за повітря, що має температуру кипіння – (- 84С0). Неприємний запах, що поширюється під час добування ацетилену з Кальцій карбіду, належить не ацетилену, а домішкам сульфідної кислоти та фосфінів, які утворюються як побічні продукти.
Хімічні властивості
Маючи у своїх молекулах π – зв’язки, алкіни є хімічно активними сполуками. Це зумовлено наявністю в їхніх молекулах потрійного зв’язку, який включає один σ - зв’язок - міцний та два π - зв’язки – менш міцні.
π - зв’язки через меншу міцність стають активними, легко розриваються, вивільняючи електрони (валентності атомів Карбону) та приєднують різні речовини. На відміну від алкенів реакції приєднання в молекулах алкінів відбуваються у дві стадії. Найхарактернішими реакціями алкінів є реакції приєднання водню, галогенів, галогеноводнів, води, повного окиснення, часткового окиснення, полімеризації, заміщення з металами.
1. Приєднання водню – РЕАКЦІЯ ГІДРУВАННЯ – при взаємодії алкінів з воднем спочатку розривається один π – зв’язок, потім другий, а на місце вільних валентностей атомів Карбону приєднуються два або чотири атоми Гідрогену (див. схему):
АЛКІН + Н2 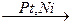 АЛКЕН
АЛКЕН  АЛКАН
АЛКАН
СН ≡ СН + Н2  СН2 = СН2
СН2 = СН2  СН3 – СН3
СН3 – СН3
Ет ин (ацетилен) Ет ен (ет илен) Ет ан
2. Приєднання галогенів (F2, CI2, Br2, J2) – ГАЛОГЕНУВАННЯ – при взаємодії алкінів з галогенами спочатку розривається один π – зв’язок, потім другий, а на місце вільних валентностей атомів Карбону приєднуються два або чотири атоми галогенів. При цьому утворюється дигалогенопохідне алкенів або етиленових вуглеводнів або тетрагалогенопохідне алканів або насичених вуглеводнів (див. схему):
АЛКІН + Hal2  ДИГАЛОГЕНОПОХІДНЕ АЛКЕНУ ДИГАЛОГЕНОПОХІДНЕ АЛКЕНУ  ТЕТРАГАЛОГЕНОПОХІДНЕ АЛКАНУ
ТЕТРАГАЛОГЕНОПОХІДНЕ АЛКАНУ
|
СН ≡ СН + СІ2  СНСІ = СНСІ
СНСІ = СНСІ  СНСІ2 – СНСІ2
СНСІ2 – СНСІ2
Ет ин (ацетилен) 1,2-дихлороет ен 1,1,2,2-тетрахлороет ан
3. Приєднання НF, НCI, НBr, НJ – ГІДРОГЕНГАЛОГЕНУВАННЯ – при взаємодії алкінів з гідрогенгалогенами спочатку розривається один π – зв’язок, потім другий, а на місце вільних валентностей атомів Карбону приєднуються одна молекула гідрогенгалогену, а потім друга утворюючи галогенопохідне алкенів або етиленових вуглеводнів або дигалогенопохідне алканів або насичених вуглеводнів (див. схему):
УВАГА! Реакція приєднання відбувається за правилом Марковнікова:
Атом Гідрогену приєднується до більш гідрогенізованого атома Карбону, а атом Галогену – до менш гідрогенізованого атома Карбону.
АЛКІН + НHal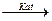 ГАЛОГЕНОПОХІДНЕ АЛКЕНУ
ГАЛОГЕНОПОХІДНЕ АЛКЕНУ 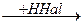
ДИГАЛОГЕНОПОХІДНЕ АЛКАНУ
СН ≡ СН + НСІ 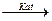 СН2 = СНСІ
СН2 = СНСІ 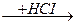 СН3 – СНСІ2
СН3 – СНСІ2
Ет ин (ацетилен) хлороет ен 1,1-дихлороет ан
4. Приєднання води – ГІДРАТАЦІЯ – РЕАКЦІЯ КУЧЕРОВА – це перетворення алкінів у альдегіди. Кучеров дослідив цю реакцію для етину (ацетилену):
АЛКІН + Н - ОН 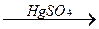 АЛЬДЕГІД
АЛЬДЕГІД
СН ≡ СН + Н – ОН  СН3 – СОН
СН3 – СОН
Ет ин (ацет илен) Ет аналь (оцтовий альдегід)
5. Повне окиснення:
| АЛКІН + О2 → СО2↑ + Н2О |
6. РЕАКЦІЯ ПОЛІМЕРИЗАЦІЇ Реакція полімеризації (етину) ацетилену називається – РЕАКЦІЄЮ ТРИМЕРИЗАЦІЇ –
відбувається під час пропускання ацетилену крізь розпечене вугілля. При цьому три молекули ацетилену сполучаються (тримеризуються) з утворенням молекули бензену (бензолу):
3 CH ≡ CH  С6Н6
С6Н6
Етин (ацетилен) Бензен (бензол)
7. ЯКІСНІ РЕАКЦІЇ НА ПОТРІЙНИЙ ЗВ’ЯЗОК
Для того, щоб визначити алкіни серед інших органічних сполук використовують реакції заміщення, в результаті яких утворюються не розчинні у воді ацетеленіди Купрум(І) і Аргентуму. Тому працюючи з ацетиленом, його не можна подавати в реакційну суміш металічними трубками, а лише трубками, виготовленими з гуми або скла:
а) Реакція заміщення – ЗА ДОПОМОГОЮ АРГЕНТУМ ГІДРОКСИДУ в розчині амоніаку – при взаємодії утворюється осад білого кольору:
Н – С ≡ C – Н + 2 AgOH  Ag – C ≡ C – Ag ↓ + 2 Н2О
Ag – C ≡ C – Ag ↓ + 2 Н2О
Аргентум ацетеленід
б) Реакція заміщення – ЗА ДОПОМОГОЮ КУПРУМ(І) ГІДРОКСИДУ – при взаємодії утворюється осад червоного-коричневого кольору:
Н – С ≡ C – Н + 2 CuOH  Cu – C ≡ C – Cu ↓ + 2 Н2О
Cu – C ≡ C – Cu ↓ + 2 Н2О
Купрум(І) ацетеленід
ДОБУВАННЯ АЛКІНІВ або АЦЕТИЛЕНОВИХ ВУГЛЕВОДНІВ
І. ЛАБОРАТОРНІ МЕТОДИ.
1. Ацетилен, який використовують для зварювальних робіт добувають на місці змішуванням Кальцій карбіду та води:
СаС2 + 2 Н2О → С2Н2 + Са(ОН)2
Кальцій карбід утворюється в результаті нагрівання в електропечах суміші негашеного вапна та коксу до температури 25000С:
СаО + 3 С → СаС2 + СО.
Цей спосіб добування етину є дуже дорогий.
1. Алкіни можна добути з дигалогенопохідних алканів при нагріванні з лугом і спиртом:
СН3 – СН2 – СН2 + 2 КОН СН3 – С ≡ СН + КBr + 2Н2О.
СН3 – С ≡ СН + КBr + 2Н2О.
| |
Br Br
І. ПРОМИСЛОВІ МЕТОДИ.
У промисловості ацетилен добувають з метану нагріванням його до температури 15000С – піролізом:
2 СН4  Н – С ≡ С – Н + 3Н2 ↑.
Н – С ≡ С – Н + 3Н2 ↑.
ЗАСТОСУВАННЯ АЛКІНІВ або АЦЕТИЛЕНОВИХ ВУГЛЕВОДНІВ
Ацетилен використовують для різання та зварювання металів.
З ацетилену (етину) добувають вихідні речовини для виготовлення пластмас (хлоровініл – СН2 = СНСІ) та каучуків (вінілацетилен НС ≡ С – СН = СН2), а також оцтового альдегіду та оцтової кислоти.
3.3. АЛКАДІЄНИ або ДІЄНОВІ ВУГЛЕВОДНІ.
АЛКАДІЄНАМИ або дієновими вуглеводнями називають органічні сполуки, в яких між атомами Карбону утворюється два подвіхних зв’язки.
Карбоновий ланцюг містить два подвійних зв’язки між атомами Карбону.
Наприклад, С = С – С – С = С;
С = С = С – С – С.
Хімічні властивості алкадієнів подібні до хімічних властивостей алкенів і алкінів.
У природі алкадієни містяться в натуральному каучуку, який добувають з соку дерева гевея та має назву латекс. У промисловості джерелом для одержання алкадієнів є природний газ та нафта. За допомогою реакції полімеризації з алкадієнів одержують синтетичні каучуки. За допомогою процесу вулканізації з канчуків одержують Ґуми.
4. АРЕНИ або АРОМАТИЧНІ ВУГЛЕВОДНІ
АРЕНАМИ або ароматичними вуглеводнями називають ненасичені сполуки циклічної будови, які мають π - електронну спряжену систему. Загальна формула ароматичних вуглеводнів – СnH2n – 6, де n ≥ 6. Міжнародна назва вуглеводнів – АРЕНИ. Найпростіший представник – БЕНЗЕН (або БЕНЗОЛ) – С6Н6.
У 1865р. німецький хімік Ф. Кекуле запропонував записувати структурну формулу молекули бензену у вигляді шестичленного циклу з атомів Карбону, між якими чергуються три одинарні та три подвійні зв’язки:

Остаточно будову молекули бензену було підтверджено реакцією утворення його з ацетилену. Але таке зображення не передає справжньої будови молекули. Насправді карбон-карбонові зв'язки у бензену рівноцінні і мають властивості, не схожі на властивості ні одинарних, ні подвійних зв’язків. Ці особливості пояснюються електронною будовою молекули бензену.
Ознаки гомологічного ряду аренів або ароматичних вуглеводнів:
1) кожний атом карбону в молекулі бензену перебуває у стані sp2 – гібридизації. Він зв'язаний з двома сусідніми атомами Карбону і атомом Гідрогену трьома σ- зв'язками. Унаслідок цього утворюється плоский шестикутник: усі шість атомів карбону і всі σ- зв'язки С –С та С – Н лежать в одній площині. У молекулі бензену немає простих і подвійних зв'язків. Молекула бензену - стійкий шестичленний цикл з однакових СН – груп, які лежать в одній площині. Усі зв'язки між атомами Карбону у бензені рівноцінні, чим і зумовлюються характерні властивості бензенового ядра. Найточніше це відбиває структурна формула бензену у вигляді правильного шестикутника з колом всередині (І) (коло символізує рівноцінність зв'язків між атомами Карбону). Однак часто користуються і формулою Кекуле із зазначенням подвійних зв'язків (II):
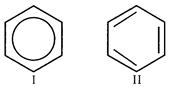
2) валентний кут (α) між атомами Карбону дорівнює 1200; α = 120°;
3) відстань (ι) між атомами Карбону дорівнює 0,140 нм; ι = 0,140 нм;
4) найпростіша молекула аренів – бензен (бензол) має плоску будову у вигляді правильного шестикутника;
5) загальна формула аренів:
СnH2n – 6
6) назва аренів утворюється при додаванні закінчення
~ бензен (~бензол);
7) гомологічний ряд аренів або ароматичних вуглеводнів утворюється внаслідок заміщення атомів Гідрогену в молекулі бензену на радикали. Приклади гомологів бензену:
 Метилбензен (метилбензол) або толуен (толуол)
Метилбензен (метилбензол) або толуен (толуол)

ВЛАСТИВОСТІ АРЕНІВ або АРОМАТИЧНИХ ВУГЛЕВОДНІВ
Фізичні властивості
Бензен (бензол) безбарвна, летка, вогненебезпечна рідина з характерним запахом. Бензен має температуру кипіння 80°С, а плавиться при 5,50С. Він не розчиняється у
воді, але добре розчиняється в органічних розчинниках і сам є розчинником для багатьох речовин. Бензен отруйний, систематичне вдихання його пари викликає анемію і лейкемію. Інші ароматичні вуглеводні, наприклад, толуен (С7Н8), менш небезпечні. При кімнатній температурі бензен інертний, а при високих температурах або за наявності каталізаторів – досить активний.
Бензен вступає в реакції заміщення:
Хімічні властивості
За рахунок ароматичного зв’язку для аренів характерні реакції приєднання (за місцем π -зв’язків) та реакції заміщення (за місцем σ- зв'язків).
1. Повне окиснення (горіння) відбувається з кіптявою за рахунок малої кількості атомів Гідрогену:
С6Н6 + 7,5О2 → 6СО2 ↑ + 6Н2О + Q
2. Часткове окиснення. Бензойне кільце стійке до дії окисників, тому розчин KMnO4 забарвлення не змінює.
3. Заміщення:
а) з галогенами
 або
або
С6Н6 + Cl2 → С6H5Cl + НCl
Бензен Хлоробензен
б) з нітратною кислотою
 або
або
С6Н6 + HO - NO2 → С6H5 - NO2 + Н2O
Бензен Нітробензен
4. Приєднання:
а) водню
 або
або
С6Н6 + 3Н2 → С6H12
Бензен Циклогексан
б) галогенів
 або
або
С6Н6 + Cl2 → С6H12Cl6
Бензен Гексациклогексан
5. Для гомологів бензену характерні ті самі реакції, що і для самого бензену. Водночас, вони мають і свої особливості. Так, толуен, на відміну від бензену, активніше вступає в реакцію нітрування з утворенням 2,4,6-тринітротолуену - вибухової речовини, відомої під назвою тротилу:
 або
або
С7Н8 + 3HO - NO2 → С6H3 – (NO2)3 + 3Н2O
Толуен (толуол) Тринітрололуен (тринітротолуол) – тротил
6. ЯКІСНА РЕАКЦІЯ НА АРЕНИ (АРОМАТИЧНИЙ ЗВ’ЯЗОК)
Для того, щоб визначити арени серед інших органічних сполук використовують такі реакції:
а) реакція НАСТЮКОВА – формалітова реакція. На скляну пластинку вміщують 1 – 2 краплі формаліну (40% й розчин метаналю), три краплі сульфатної кислоти та одну краплю бензену (бензолу) або його гомологу. У утворюється червоний осад.
б) реакція на БЕНЗЕН. При дії нітратної кислоти на бензен утворюється нітробензен. Коли до реакційної суміші додати води, утворюється масляниста рідина їз запахом гіркого мигдалю – НІТРОБЕНЗЕН:
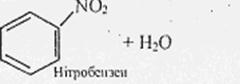

ДОБУВАННЯ та ЗАСТОСУВАННЯ АРЕНІВ або АРОМАТИЧНИХ ВУГЛЕВОДНІВ
Бензен добувають з нафти, кам’яновугільної смоли та кам’яного вугілля, тримеризацією етину (ацетилену):
 або
або
3С2Н2 → С6Н6
Бензен використовується як розчинник, а також як сировина для виробництва нітробензолу, аніліну, гексахлорану, хлорбензену, фенолу, ліків, пластмас, барвників, отрутохімікатів та багатьох інших органічних речовин. Бензеп як добавка поліпшує
якість моторного палива.
ВЗАЄМОПЕРЕТВОРЕННЯ ВУГЛЕВОДНІВ

|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1426; Нарушение авторских прав?; Мы поможем в написании вашей работы!