
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эволюция теорий атома
|
|
|
|
ЧЕТВЕРТАЯ ЛЕКЦИЯ
Уважаемые искатели истины!
На этом я останавливаю свою третью лекцию. Понимаю, что у Вас возникло много вопросов. Ответы на многие из них Вы найдете в шестом издании книги «Начала физхимии микромира» [2], которая готовится к печати. Главная особенность этой книги – она вся написана в рамках Аксиомы Единства. Произошло это потому, что автор этой книги первый заметил моё существование и значимость. Мне известно, что среди Вас немало тех, кто следовал моим заветам неосознанно и получал результаты, не противоречащие реальной действительности. Думаю, что мы услышим еще Ваши лекции в этом великолепном актовом зале.
Я буду следить за процессом освоения Вами изложенных знаний и, если он будет успешным, то сама объявлю Вам тему следующей лекции. Всего Вам доброго и главное – творческих успехов.
ЛИТЕРАТУРА
1. Канарёв Ф.М. Начала физхимии микромира. Пятое издание. Краснодар 2004. 400 с.
2. Канарёв Ф.М. Начала физхимии микромира. Шестое издание. 500 с. Подготовлено к печати.
3. Грот С. Р., Сатторп Л.Г. Электродинамика. М. «Наука». 1982. 560с.
4. Никольский В.В., Никольская Т.И. Электродинамика и распространение радиоволн. М. «Наука». 1989. 543 с.
5. Эдельман В.С. Вблизи абсолютного нуля. М. «Наука» 1983. 174 с.
6. Аллан Холден. Что такое ФТТ. М. «Мир».1979.
7. Вихман Э. Квантовая физика. М.: «Наука» 1977. 415 с.
8. Спроул Р. Современная физика. Квантовая физика атомов твердого тела и ядер. М. «Наука» 1974. 591с.
9. Сборник рекомендуемых терминов. Выпуск 90. Теоретическая механика. Терминология. М. "Наука". 1977. 45с.
10. Сборник терминов по Классической механике. На пяти языках. Варшава, 1965. 192с.
11. Канарёв Ф.М., Артёмов И.И., Зеленский С.А. Конспект лекций по теоретической механике. Краснодар, 2001. 265 с.
|
|
|
12. Бурдун Г.Д. Справочник по международной системе единиц СИ. Издательство стандартов. М. 1977.
13. Walter Kranzer. So Interesant Physic. Berlin. 1990. 364 с.
14. Панченко А.И. Логико-гносиологические проблемы квантовой физики. М.: «Наука». 1981.
15. Фон Нейман. Математические основы квантовой механики. М.: «Наука». 1964
- Введение
Уважаемые искатели научной истины, Вы уже вооружены знаниями условий реализации Аксиомы Единства. Она помогла нам найти уравнения для расчета спектров атомов и ионов, из которых следует отсутствие орбитального движения электрона в атоме. Теперь мы должны понять суть ошибочности постулатов и теорий атома, доказывавших орбитальное движение электрона. Наиболее последовательно эти постулаты и теории кратко изложены в книге [1].
Первое представление о структуре атома было теоретически обосновано Нильсом Бором в 1913 г. Главным его вкладом в теорию атома является гипотеза о квантовании орбитального момента импульса 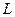 электрона атома водорода [1]
электрона атома водорода [1]
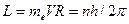 , (114)
, (114)
где 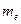 - масса электрона;
- масса электрона; 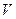 - орбитальная скорость электрона;
- орбитальная скорость электрона;  - радиус орбиты;
- радиус орбиты; 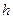 - постоянная Планка;
- постоянная Планка; 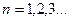 - номер орбиты, главное квантовое число.
- номер орбиты, главное квантовое число.
Из условия квантования (114), как мы уже показали, легко выводится формула (25) для расчета спектра атома водорода [1]. Считается, что правило квантования орбитального момента импульса, предложенное Нильсом Бором, оставалось гипотезой до тех пор, пока Луи Де Бройль[2] не высказал предположение о том, что длина волны 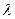 электрона связана с его импульсом
электрона связана с его импульсом 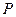 соотношением
соотношением 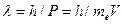 и что в орбите электрона должно укладываться целое число
и что в орбите электрона должно укладываться целое число 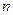 волн электрона
волн электрона 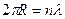 . Из этого сразу последовал постулат Бора о квантовании орбитального момента импульса
. Из этого сразу последовал постулат Бора о квантовании орбитального момента импульса 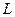 электрона [1]
электрона [1]
 (115)
(115)
и появилась странность. Как понимать тот факт (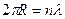 ), что длина окружности первой орбиты (
), что длина окружности первой орбиты (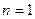 ) равна одной длине волны
) равна одной длине волны 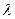 электрона? Отсутствие ответа на этот вопрос не смутило Арнольда Зоммерфельда и он предложил в 1915 г. теорию о движении электронов по эллиптическим орбитам. При этом он допустил, что энергия электрона на каждой из таких орбит не меняется. Меняется только орбитальный момент импульса
электрона? Отсутствие ответа на этот вопрос не смутило Арнольда Зоммерфельда и он предложил в 1915 г. теорию о движении электронов по эллиптическим орбитам. При этом он допустил, что энергия электрона на каждой из таких орбит не меняется. Меняется только орбитальный момент импульса 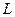 . Конечно, это странное допущение и, тем не менее, оно было принято, и процесс развития теории атома в орбитальном направлении продолжился [1].
. Конечно, это странное допущение и, тем не менее, оно было принято, и процесс развития теории атома в орбитальном направлении продолжился [1].
|
|
|
Зоммерфельд ввел новое правило квантования орбитального момента импульса. Вместо зависимости (116) он предложил зависимость [1]
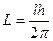 , (116)
, (116)
где 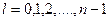 - второе квантовое число.
- второе квантовое число.
В результате появилась необъяснимая закономерность изменения обоих квантовых чисел 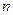 и
и 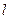 . Так при
. Так при 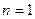 ,
, 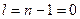 . Когда
. Когда  , второе квантовое число принимает значения 0 или 1. Если
, второе квантовое число принимает значения 0 или 1. Если 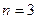 , то
, то 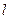 принимает значения 0, 1 или 2 и т. д. При расчете спектров было установлено, что
принимает значения 0, 1 или 2 и т. д. При расчете спектров было установлено, что 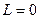 для основного состояния электрона. Однако с точки зрения классической механики электрон в этом случае должен двигаться по прямой линии, проходящей через ядро [1].
для основного состояния электрона. Однако с точки зрения классической механики электрон в этом случае должен двигаться по прямой линии, проходящей через ядро [1].
Так множились противоречия теории орбитального движения электрона в атоме и неясно было, как эти противоречия устранять. Почему орбитальный момент импульса электрона должен равняться нулю, когда он находится на первой орбите? Этот вопрос висит в воздухе до сих пор. Физики и химики привыкли к такому положению и уже не замечают этого вопроса. Не получив ответа на него, исследователи пошли дальше. Они присвоили названия состояниям электрона в момент, когда он имеет различные орбитальные моменты импульса (табл. 15) [1].
Таблица 15.
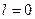
| 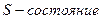
|
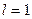
| 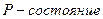
|
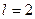
| 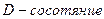
|
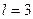
| 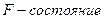
|
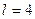
| 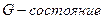
|
Последующие исследования показали, что в действительности орбитальный момент импульса изменяется по зависимости [1]
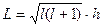 . (117)
. (117)
Углубление теории орбитального движения Зоммерфельдом не позволило рассчитывать спектры атомов сложнее водородоподобных (атомов и ионов с одним электроном) атомов. Это означало отсутствие понимания процесса взаимодействия электрона с ядром атома. Но на это не обращали внимание и двигались дальше в ложном направлении [1].
Так как заряд электрона отрицательный, то было принято соглашение считать, что векторы орбитального момента импульса 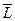 и магнитного момента
и магнитного момента 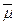 электрона направлены противоположно. Странное соглашение. Векторные свойства физическим величинам задаёт Природа, а знак электрону приписан человеком. Разве этого достаточно, чтобы считать векторы
электрона направлены противоположно. Странное соглашение. Векторные свойства физическим величинам задаёт Природа, а знак электрону приписан человеком. Разве этого достаточно, чтобы считать векторы 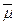 и
и 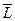 противоположно направленными? [1].
противоположно направленными? [1].
|
|
|
Следующее соглашение оказалось ещё абсурднее. Известно, что спин 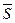 – величина векторная. Он характеризует вращение частицы, в данном случае - вращение электрона относительно своей оси симметрии. Чтобы объяснить расщепление спектральных линий при наличии магнитного поля, было принято соглашение считать, что его проекция
– величина векторная. Он характеризует вращение частицы, в данном случае - вращение электрона относительно своей оси симметрии. Чтобы объяснить расщепление спектральных линий при наличии магнитного поля, было принято соглашение считать, что его проекция 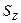 на выбранное направление может иметь лишь два значения [1]
на выбранное направление может иметь лишь два значения [1]
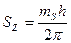 , (118)
, (118)
где 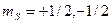 .
.
На этом странности теории атома не закончились. Было введено понятие «полный момент импульса», равный 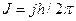 . Здесь
. Здесь 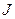 - квантовое число полного момента импульса, а величина
- квантовое число полного момента импульса, а величина 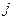 изменятся так
изменятся так 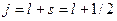 и
и 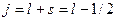 [1].
[1].
Странно, но вопрос о закономерности изменения энергии связи электрона с ядром атома при орбитальных переходах электрона так никто и не поставил. А ведь это главный вопрос при анализе всех химических реакций. Почему он не был поставлен? Это - загадка и историки науки, несомненно, будут разгадывать её. Не был поставлен и второй фундаментальный вопрос: каким образом электроны двух атомов, летающие по орбитам вокруг их ядер, соединяют атомы в молекулы? Вместо того, чтобы поставить эти вопросы и искать на них ответы, исследователи пошли дальше в тупиковом направлении. Обилие квантовых чисел затуманило орбитальное движение электрона в атоме. Плотность этого тумана увеличило уравнение Шредингера, за которое он вместе с Дираком получил Нобелевскую премию в 1933 [4]. В трехмерном пространстве уравнение Шредингера имеет вид [5]
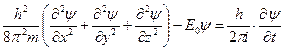 (119)
(119)
Решением этого уравнения является функция
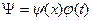 , (120)
, (120)
в которой координата 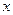 независима от времени
независима от времени 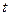 . В этом случае результат решения (120) однозначно противоречит Аксиоме Единства пространства - материи - времени и поэтому оказывается далеким от реальной действительности. Несмотря на это, считается, что уравнение Шредингера играет в механике микромира такую же роль, как и уравнения Ньютона в механике макромира, которые, заметим, работают в рамках Аксиомы Единства [2], [3],[6], [7].
. В этом случае результат решения (120) однозначно противоречит Аксиоме Единства пространства - материи - времени и поэтому оказывается далеким от реальной действительности. Несмотря на это, считается, что уравнение Шредингера играет в механике микромира такую же роль, как и уравнения Ньютона в механике макромира, которые, заметим, работают в рамках Аксиомы Единства [2], [3],[6], [7].
|
|
|
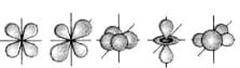
Из уравнения Шредингера (119) следовала невозможность определения положения электрона в атоме. Можно было оценить лишь плотность вероятности пребывания его в атоме. Чтобы спасти идею орбитального движения электрона, плотность этой вероятности назвали орбиталью и стали представлять её в виде электронного облака определенной формы (рис. 13) [7].
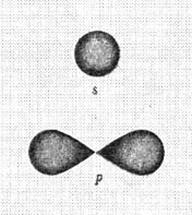
 а) S – орбиталь; b) P - орбиталь
а) S – орбиталь; b) P - орбиталь
|  с) d - орбитали
с) d - орбитали
|
Рис. 13. Формы электронных облаков
Как видно (рис. 13), формы орбиталей весьма далеки от форм круговых и эллиптических орбит, но это не смущает физиков и химиков. Они продолжают считать, что электроны в атомах движутся по орбитам [7].
Завершил тупиковый путь Паули, сформулировавший принцип, согласно которому в атоме не может быть электронов, имеющих все одинаковые квантовые числа. За это ему была присуждена Нобелевская премия в 1945 г с такой формулировкой: «За открытие принципа, названного его именем (Принцип Паули)» [4].
Такой путь развития теории атома не дал самую необходимую информацию - закономерность изменения энергий связи электронов с ядрами. В результате химики до сих пор не знают энергии связи электрона атома водорода с протоном, не говоря уже о других атомах и электронах. Но самое удивительное в том, что они не желают даже знать о том, что это нужно знать. И совсем не интересуются информацией о том, что эта задача уже решена [2], [3].
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 304; Нарушение авторских прав?; Мы поможем в написании вашей работы!