
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика реакций в области собственной химической кинетики
|
|
|
|
(недиффузионная кинетика)
Кинетика гетерогенных каталитических процессов подчиняется законам, которые свойственны кинетике сложных реакций, специфические ееособенности обусловлены тем, что процесс совершается в мономолекулярном слое на поверхности катализатора. Если подвод Сг очень быстрый и отвод вещества от поверхности велик, т.ч. Сг ≈ Сп и перенос внутри пористого зерна очень быстрый, так что Сг ≈ Сп ≈ Св, то говорят, что реакция протекает в области собственной химической кинетики.
Основными стадиями гетерогенного процесса являются:
1. Массоперенос реактантов и продуктов путем встречной диффузии между объемом жидкой или газовой фазы и внешней поверхностью зерна катализатора.
2. Массоперенос реагентов и продуктов встречной диффузией через пористую структуру катализатора.
3. Адсорбция реагентов на поверхности катализатора и десорбция продуктов.
4. Химическая реакция с участием одной или нескольких хемосорбированных частиц.
Скорость этих стадий зависит от поверхностных концентраций реагентов, которые недоступны непосредственному определению в обычных кинетических экспериментах. Задача состоит в том, чтобы скорость реакции W выразить как функцию экспериментально измеряемых концентраций Сi или парциальных давлений Рi в газовой фазе. Для этого необходимо знать характер зависимости a = f (Ci).
Относительно более простым и удобным для анализа является случай, когда процесс происходит на однородной поверхности в отсутствии взаимного влияния адсорбированных частиц. Это соответствует по терминологии, предложенной М.И. Темкиным, картине идеального адсорбированного слоя.
Основой кинетики гетерогенно-каталитических процессов в идеальном адсорбированном слое является сформулированный Лэнгмюром закон действующих поверхностей (ЗДП), аналогичный закону действующих масс (ЗДМ) для гомогенных реакций.
|
|
|
Рассмотрим реакцию:
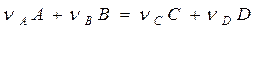
происходящую таким образом, что оба реагента (А и В) вступают в химическое взаимодействие из адсорбированного состояния (так называемый механизм Лэнгмюра –Хиншельвуда). Согласно закона Лэнгмюра, скорость прямого процесса W выражается следующим образом:
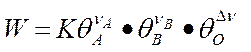
множитель 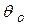 - свободная поверхность,
- свободная поверхность,
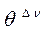 - выражает необходимость наличия свободной поверхности для размещения на ней всех продуктов реакции,
- выражает необходимость наличия свободной поверхности для размещения на ней всех продуктов реакции,
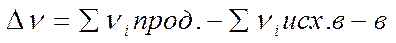 - разность количеств элементарных мест, занимаемых на поверхности продуктами и исходными веществами.
- разность количеств элементарных мест, занимаемых на поверхности продуктами и исходными веществами.
Возможны случаи, когда поверхностная химическая реакция осуществляется путем взаимодействия реагентов, один из которых, например, А адсорбирован, а другой В налетает из газовой фазы (механизм Ридила). В данном случае множитель 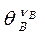 - следует заменить на
- следует заменить на 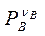 - парциальное давление вещества В.
- парциальное давление вещества В.
На основании закона действующих поверхностей (ЗДП) могут быть получены конкретные кинетические уравнения в которых скорость выражена как функция парциальных давлений участвующих в реакции веществ.
Допустим, что в ходе катализа процессы адсорбции реагентов и десорбции продуктов происходят значительно быстрее, чем поверхностная химическая реакция, т.е. последняя является лимитирующей стадией. Тогда величины степеней 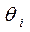 можно считать равновесными по отношению к парциальным давлениям веществ в газовой фазе
можно считать равновесными по отношению к парциальным давлениям веществ в газовой фазе 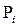 . Этот случай обычно называют кинетикой Лэнгмюра – Хиншельвуда. Одна из основных ее особенностей - предположение о наличии адсорбционного равновесия между веществами в газовой фазе и на поверхности катализатора: идущий на поверхности химический процесс совершается настолько медленно, что он не успевает нарушить это равновесие. Это позволяет подставить в выражение для скорости вместо
. Этот случай обычно называют кинетикой Лэнгмюра – Хиншельвуда. Одна из основных ее особенностей - предположение о наличии адсорбционного равновесия между веществами в газовой фазе и на поверхности катализатора: идущий на поверхности химический процесс совершается настолько медленно, что он не успевает нарушить это равновесие. Это позволяет подставить в выражение для скорости вместо 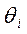 парциальные давления:
парциальные давления:
|
|
|
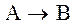
протекает по схеме:
1. А + () ↔ (А)
2. (А) → (В) - лимитирующая стадия
3. (В) ↔ В + ()
В стадиях 1 и 3 практически устанавливается равновесие, лимитирующей является химическая реакция на поверхности (2)

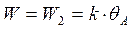
т.к. 1 стадия равновесная, то 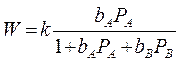
1. Когда адсорбция всех веществ мала, т.е. в области малых заполнений поверхности адсорбированными частицами:
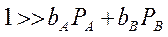
выражение переходит в уравнение первого порядка:
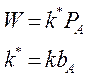
2. Если значительно преобладает адсорбция исходного вещества А, т. е.:
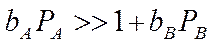
и 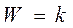 - реакция протекает по нулевому порядку, т.е. скорость реакции не зависит от давлений реагентов.
- реакция протекает по нулевому порядку, т.е. скорость реакции не зависит от давлений реагентов.
3. Если сильная адсорбция продукта В:
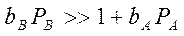
процесс тормозится продуктом В:

где 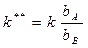
Если в реакции, протекающей по механизму Лэнгмюра – Хиншельвуда в идеальном адсорбированном слое участвуют два реагента, то выражение для скорости прямого процесса имеет вид:
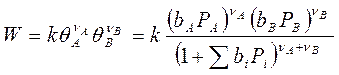
Рассмотрим это на конкретных примерах:
1. Дегидратация этилового спирта:
С2Н5ОН → Н2О + С2Н4
Этиловый спирт разлагается, предварительно адсорбируясь:
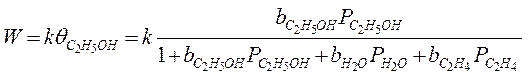
Предельные случаи:
1. адсорбция всех веществ мала, т.е.:
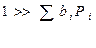
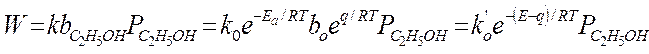
Формально уравнение Аррениуса выполняется, но Еакт = Е – qcп. – это будет кажущейся Eакт.
 |
2. Пусть сильная адсорбция этилового спирта, а все остальные вещества адсорбируются слабо:
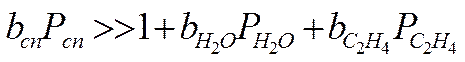
W = k
Порядок по реагентам равен нулю, Еакт - истинная, закон Аррениуса выполняется.
 3. Сильная адсорбция для этилового спирта и воды:
3. Сильная адсорбция для этилового спирта и воды:
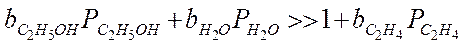

Зависимость скорости от температуры сложная, в общем случае уравнение Аррениуса выполняться не будет.
lg W

II. Бимолекулярные реакции
Хлорирование ацетилена с получением хлорвинила:
С2Н2 + НСl → С2H3Cl
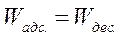
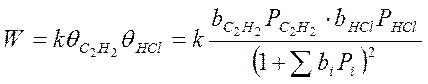
Частные случаи:
1. Адсорбция всех веществ мала:
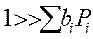
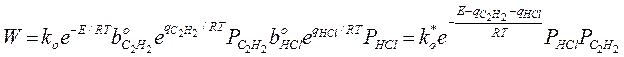
Закон Аррениуса выполняется, но Еакт кажущиеся, она меньше на теплоту адсорбции HCl и С2Н2. Скорость по реагирующим веществам имеет 2-ой порядок.
2. Если только адсорбция ацетилена велика, т.е.:
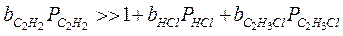

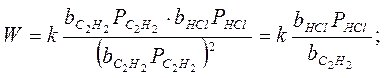
т.е. скорость реакции не увеличивается с увеличением концентрации ацетилена, а уменьшается. Мы предположили сильную адсорбцию С2Н2, но чтобы реакция протекала, нужно чтобы и НСl адсорбировался, а т.к. С2Н2 вытесняет НСl с поверхности, поэтому скорость реакции уменьшается с увеличением парциального давления ацетилена.
|
|
|
3. Если бы реакция протекала без катализатора:
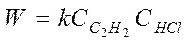
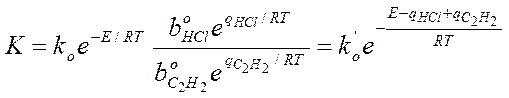
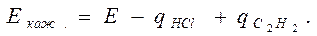
Кинетику этой реакции изучал Баландин и он предположил, что вещества: ацетилен и соляная кислота адсорбируются на различных участках поверхности, а взаимодействие между ними происходит на границах этих участков, тогда:
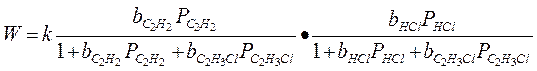
Если предположить, что адсорбция исходных веществ (С2Н2 и НСl) велика:
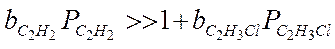
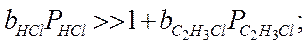
тогда 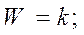
Реакция получается нулевого порядка, Еакт истинная и закон Аррениуса выполняется.
Кинетика Лэнгмюра-Хиншельвуда наблюдается для ряда реакций: крекинг углеводородов, дегидратация спиртов, окисление пропилена в акролеин, конверсии метана.
Изотерма Лэнгмюра описывает равновесные процессы.
Одна из основных особенностей кинетики Лэнгмюра – Хиншельвуда - предположение о наличии адсорбционного равновесия между веществами в газовой фазе и на поверхности катализатора: идущий на поверхности химический процесс совершается настолько медленно, что он не успевает нарушить это равновесие.
В действительности, возможны случаи, когда наиболее трудным этапом является активированная адсорбция (или десорбция) реагентов, протекающих значительно медленнее, чем поверхностная химическая реакция.
Рассмотрим кинетику процесса, лимитирующей стадией которого является хемосорбция исходного вещества. Предположим, что при протекании реакции
А → В по схеме:
1. А + () → (А) - адсорбция
2. (А) ↔ (В) - химическая реакция
3. (В) ↔ В + () - десорбция.
Медленной стадией является адсорбция вещества А (1 стадия –адсорб-ция), тогда скорость всего процесса равна скорости адсорбции молекул вещества А:
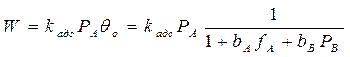
т.к. первая стадия не равновесная, то
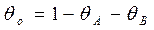
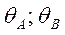 - как по изотерме Лэнгмюра вместо РА подставляем летучесть fA. Поскольку в стадии 1 равновесие сильно нарушено, то поверхностная концентрация вещества А не является равновесной по отношению к парциальному давлению вещества А в газовой фазе. Однако последующие стадии предполагаются практически равновесными. Это означает, что молекулы вещества В в газовой фазе находятся в равновесии не только с адсорбированным веществом В, но также и с адсорбированным веществом А. Такое равновесие называется адсорбционно-химическим, поскольку его можно представить как комбинацию адсорбционного равновесия реакции 3 с химическим равновесием стадии 2:
- как по изотерме Лэнгмюра вместо РА подставляем летучесть fA. Поскольку в стадии 1 равновесие сильно нарушено, то поверхностная концентрация вещества А не является равновесной по отношению к парциальному давлению вещества А в газовой фазе. Однако последующие стадии предполагаются практически равновесными. Это означает, что молекулы вещества В в газовой фазе находятся в равновесии не только с адсорбированным веществом В, но также и с адсорбированным веществом А. Такое равновесие называется адсорбционно-химическим, поскольку его можно представить как комбинацию адсорбционного равновесия реакции 3 с химическим равновесием стадии 2:
|
|
|
Стадии 2 и 3 равновесные,
(А) ↔ В + () – адсорбционно-химическое равновесие
Константа равновесия реакции (А) ↔ В + ():
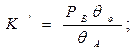
учитывая, что:
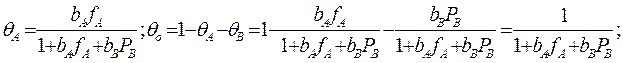
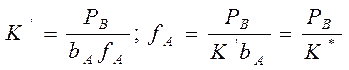
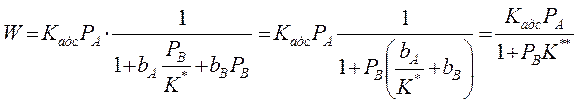
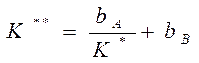
Если рассчитанная скорость реакции равна экспериментальной скорости, то предполагаемый механизм – правильный.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 577; Нарушение авторских прав?; Мы поможем в написании вашей работы!