
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отримання
|
|
|
|
Отримання. Метан широко розповсюджений у природі. Він є головною складовою частиною багатьох горючих газів як природних (90-98 %), так і штучних, що виділяються при сухій перегонці деревини, торфу, кам”яного вугілля, а також при крекінгу нафти. Природні гази, особливо супутні гази нафтових родовищ, окрім метану містять етан, пропан, бутан і пентан. Метан виділяється із дна болот та кам”яновугільних пластів в копальнях, де він утворився в умовах повільного розкладу рослинних залишків при відсутності кисню. Тому метан часто називають болотним або рудничним газом.
Фізичні властивості. В звичайних умовах перші чотири члени гомологічного ряду алканів (С1—С4)— гази. Нормальні алкани від пентану до гептадекану (С5—С17) – рідини, починаючи з С18 і вище – тверді речовини. Із збільшенням кількості атомів карбону в ланцюгу, тобто з ростом від-носної молекулярної маси, підвищуються температури кипіння і плавління алканів. При однаковій кількості атомів карбону в молекулі алкани з розгалуженою будовою мають більш низькі темпера-тури кипіння, ніж нормальні алкани. Алкани практично нерозчинні в воді, оскільки їх молекули малополярні і не взаємодіють з молекулами води. Рідкі алкани легко змішуються один з одним. Вони добре розчиняються в неполярних органічних розчинниках, таких як бензол, тетрахлорметан та ін.
Згідно з систематичною номенклатурою IUPAC, першим чотирьом членам гомологічного ряду алканів присвоєні їх історично утворені назви – метан, етан, пропан, бутан. Назви останніх алканів з нормальним, тобто нерозгалуженим, карбоновим ланцюгом складаються їз грецьких або латин-ських назв чисельника, що відповідає числу атомів карбону в ланцюгу, з добавленням суфіксу –ан. Так, грецька назва чисельника 5 – „пента”, тому вуглеводень С5Н12 називається пентан. Для тієї ж сполуки можна зустріти назву н-пентан, що підкреслює наявність нормального ланцюгу. Почина-ючи з бутану і далі для кожного нормального алкана існують структурні ізомери з розгалуженим ланцюгом. Структурна ізомерія обумовлює різноманітність вуглеводневих радикалів. Останній отримується, якщо від молекули алкану відібрати один атом гідрогену. Цей термін не слід плутати з поняттям „вільний радикал”, що характеризує атом з неспареним електроном. Назва радикала походить від назви відповідного алкану із заміною суфіксу -ан на суфікс -іл. Загалом, радикали, що походять від аліфатичних вуглеводнів, називають алкільними і позначають через R. Ізомерія радикалів починається з пропану, для якого можливі два ізомерних радикали. Якщо атом гідрогену відняти від первинного атому карбону, то отримаємо радикал пропіл (н-пропіл), якщо від вторин-ного – буде радикал ізопропіл.
|
|
|
Згідно з будовою карбонового скелету вуглеводні розподіляють на аліфатичні (з відкритим карбоновим ланцюгом) і циклічні (з замкненим карбоновим ланцюгом). В залежності від типу зв”язків між атомами карбону як аліфатичні, так і циклічні вуглеводні діляться на насичені, що мають тільки s -зв”язки, і ненасичені, які мають як s - так і p -зв”язки. До насичених вуглеводнів належать алкани і циклоалкани.
Алкани і циклоалкани
Алкани – є насиченими вуглеводнями, оскільки всі вільні валентності атомів карбону зайняті (пов-ністю „насичені”) атомами гідрогену. Алкани називають також парафінами (цей термін означає „ті, що мають низьку спорідненість”). Найпростіший представник алканів – метан СН4. Починаючи з нього, можна побудувати ряд, в якому кожний наступний вуглеводень відрізняється від поперед-нього на одну групу СН2. Загальна формула гомологічного ряду алканів СnН2n+2.
|
|
|
1. Отримання із ненасичених вуглеводнів.
Взаємодія алканів з гідрогеном відбувається в присутності металевих каталізаторів (Ni, Pd) при нагріванні:

2. Отримання із галогенпохідних
При нагріванні моногалогензаміщених алканів з металевим натрієм отримують алкани з подвійною кількістю атомів карбону (реакція Вюрца):

Подібну реакцію не проводять з двома різними галогензаміщеними алканами, оскільки при цьому утворюється суміш трьох різних алканів.
3. Отримання із солей карбонових кислот.
В результаті сплавлення безводних солей карбонових кислот з лугами отримують алкани, які містять на один атом карбону менше в порівнянні з карбоновим ланцюгом вихідних карбонових кислот:
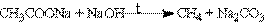
4. Отримання метану
В електричній дузі, що горить в атмосфері гідрогену, утворюється значна кількість метану:

Така ж реакція йде при нагріванні карбону в атмосфері гідрогену до 400-500 оС при підвищеному тиску в присутності каталізатору. В лабораторних умовах метан часто отримують із карбіду алюмінію:
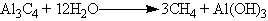
Хімічні властивості. У звичайних умовах алкани хімічно інертні. Вони є сталими до дії багатьох реагентів: не взаємодіють з концентрованими сірчаною і азотною кислотами, з концентрованими і розплавленими лугами, не окиснюються сильними окисниками – перманганатом калію і т.д. Хімічна сталість алканів пояснюється високою міцністю s -зв”язків С – С і С – Н, а також їх неполярністю. Неполярні зв”язки С – С і С – Н в алканах не схильні до іонного розриву, але здатні до гомолітичного розщеплення під дією активних вільних радикалів. Тому для алканів характерні радикальні реакції, в результаті яких отримуються сполуки, де атоми гідрогену заміщені на інші атоми або групи атомів. Алкани вступають в реакції, які плинуть по механізму радикального заміщення (позначаються символом SR (від англ. substitution radicalic). За цим механізмом легше всього йде заміщення атомів гідрогену у третинних, потім у вторинних і первинних атомів карбону.
1. Галогенування При взаємодії алканів з галогенами (хлором і бромом) під дією УФ-випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогензаміщених алканів. Загальна схема такої реакції показана на прикладі метана:
|
|
|
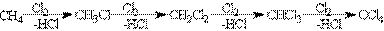
- Нітрування (реакц ія Коновалова ).
При дії розбавленої азотної кислоти на алкани при 140 оС і невеликому тиску йде радикальна реакція; 
- Ізомерізація.
Нормальні алкани за певних умов можуть перетворюватись в алкани з розгалуженим ланцюгом: 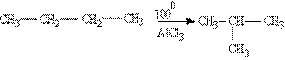
Окиснення.
При м”якому окисненні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
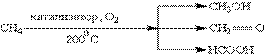
У повітрі алкани згоряють до СО2 і Н2О.
Застосування алканів. Воно досить різноманітне. Завдяки великій теплотворній здатності метан в значних об”ємах витрачається в якості палива (в побуті – побутовий газ і в промисловості). Широко застосовуються і речовини, що отримуються з нього – гідроген, ацетилен, сажа. Він служить вихід-ною сировиною для отримання формальдегіду, метилового спирту, а також різних синтетичних продуктів.
Велике промислове значення має окиснення вищих насичених вуглеводнів – парафінів з числом атомів карбону 20-25. У такий спосіб отримують синтетичні жирні кислоти з різною довжиною ланцюгу, які використовують для виробництва мил, різних миючих засобів, мастильних матеріалів, лаків, емалей. Рідкі вуглеводні використовують як паливо (вони входять у склад бензину і гасу). Алкани широко використовують в органічному синтезі.
Циклоалкани – Загальна формула гомологічного ряду циклоалканів С2Н2n. Такою ж формулою описується гомологічний ряд алкенів, з чого витікає, що для кожного циклоалкану існує ізомер – відповідний алкен – це приклад так званої „міжкласової” ізомерії. Структурні формули цикло-алканів зазвичай записують у скороченому вигляді, використовуючи геометричну форму циклу і відкидаючи символи атомів карбону і гідрогену.
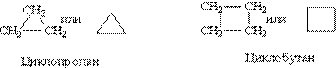
Структурна ізомерія циклоалканів обумовлена розміром циклу (наприклад, циклобутан і метил-циклопропан – ізомери) і положенням замісників в циклі (наприклад, 1,1- і 1,2-диме-тилбутан). Для циклоалканів характерний ще один вид ізомерії – просторова ізомерія, що зв”язана з різним розта-шуванням замісників відносно площини циклу. При їх розташуванні з одної сторони від площини циклу отритмується цис-ізомер, з різних сторін – транс-ізомер.
|
|
|
Фізичні властивості. Першідва члени цього ряду – гази, С5—С16 — рідини, починаючи з С17 і вище – тверді речовини. Температури кипіння і плавління циклоалканів дещо вище, ніж у алканів при однаковій кількості атомів карбону.
Загальним способом отримання циклоалканів є дія металів на дігалогенопохідні алканів:
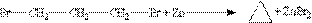
Сполуки ряду циклогексану отримують гідруванням ароматичних вуглеводнів, наприклад: 
Хімічні властивості. В будові циклоалканів існує ряд особливостей, що визначають їх хімічні властивості. Малі цикли (особливо циклопропан) нестійкі і здатні до розриву, тому вони схильні до реакцій приєднання, що нагадує ненасичені сполуки. Так, циклопропан приєднує бром з розривом циклу, утворюючи 1,3-дібромпропан:
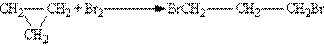
Звичайні цикли дуже стійкі і вступають тільки в реакції заміщення, подібно алканам:

|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 776; Нарушение авторских прав?; Мы поможем в написании вашей работы!