
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7. Электроды
|
|
|
|
Окислительно-восстановительный процесс можно провести обычно, химически, а можно электрохимически в электроде. Один случай уже был рассмотрен – электрод 1 рода, когда металл погружается в водный раствор собственной соли (растворимой): Zn|ZnSO4 - цинковый, Cu|CuSO4 - медный, Ag|AgNO3 – серебряный и др. Потенциал последнего серебряного электрода зависит от концентрации катионов серебра – это электрод, обратимый по отношению к катиону:
εAg = εoAg + 0,059 lgCAg.
Усложним конструкцию, введем в систему на границу фаз серебро – раствор труднорастворимую соль серебра, тогда получится электрод, обратимый как к катиону, так и к аниону – электрод 2 рода, хлорсеребряный: Ag|AgCI + KCI. На серебряный пруток нанесен слой хлористого серебра и этот пруток помещается в раствор электролита - хлористого калия. В этом случае концентрации ионов серебра и хлора связаны величиной произведения растворимости ПРAgCI:
ПРAgCI = C Ag+ • CCI─, отсюда C Ag+ = ПРAgCI/ CCI─.
εAgCI = εoAg + 0,059 lg ПРAgCI ─ 0,059lg CCI─ = εoAgCI ─ 0,059lg CCI─.
Потенциал такого электрода зависит от концентраций катиона и аниона. Другим примером является каломельный электрод (каломель – Hg2CI2): Hg| Hg2CI2 + KCI.
В систему вместо труднорастворимого вещества можно ввести газ, тогда получатся так называемые газовые электроды. Так, из реакции восстановления кислорода, растворенного в воде:
O2 + 2H2O + 4e «4OH─
можно сделать кислородный электрод. Для этого нужен раствор, содержащий ионы гидроксила (NaOH) и инертный металл (Pt). Газоообразный кислород подают на поверхность платины, как это изображено на рис.7.1.

Рис.7.1 Кислородный электрод
Для улучшения адсорбции кислорода на платине ее поверхность специальным образом обрабатывают – она покрыта слоем губчатой, аморфной платины, так называемой «платиновой чернью». Такая развитая (каталитическая) поверхность активно поглощает пузырьки кислорода и на ней устанавливается равновесие между окисленной (О2) и восстановленной (ОН─) формами. Если на такую платиновую пластину, погруженную в раствор соляной кислоты, подавать газообразный хлор, получится хлорный электрод (СI2)Pt|HCI. На нем протекает реакция CI2 + 2e «2CI─.
|
|
|
Особую роль выполняют электроды сравнения, относительно которых проводят электрохимические измерения. Прежде всего, это стандартный водородный электрод, который также относится группе газовых. В раствор серной кислоты помещается платина с платиновой чернью, на которую подается газообразный водород: (H2)Pt|H2SO4. На платине устанавливается равновесие:
H2 ─ 2e «2H+,
K = C2H+ /PH2
εH2 = εo H2 + (0,059/2) lg C2H+ /PH2 = εo H2 + 0,059 lg CH+ ─ 0,059lgPH2.
Газообразный водород подают под давлением 1атм, один логарифмический член исчезает:
εH2 = εo H2 + 0,059lg CH+.
Дальнейшая стандартизация связана с выбором концентрации серной кислоты, чтобы ей соответствовала стандартная концентрация ионов водорода СH+= 1моль/л, тогда:
εH2 = εo H2 ≡ 0
Стандартный потенциал водородного электрода положен равным нулю, это и есть начало отсчета, относительно этого нуля установлены абсолютные значения электродных потенциалов металлов Ряд напряжений металлов, (табл.6.1) построен относительно водородного электрода.
Стандартный водородный электрод представляет достаточно сложный, дорогой электрохимический прибор, требующий специальной платины, особо чистого водорода, системы контроля за давлением этого водорода и т.п. Он в настоящее время применяется только в специальных исследованиях. На практике его успешно заменяют более простые, дешевые и надежные электроды сравнения типа хлорсеребряного.
Поверхность инертного металла (платины) в растворе электролита может выполнять только функцию «резервуара» электронов – отдавать или принимать электроны от компонентов раствора. В этом случае электродный потенциал будет служить мерой окислительно-восстановительной способности самого раствора, это так называемые окислительно-восстановительные (red-ox) электроды. Например, погружаем платину в раствор окислителя – соли трехвалентного железа. На поверхности платины протекает реакция восстановления ионов трехвалентного железа до двухвалентного состояния:
|
|
|
(+) Pt | Fe3+ Fe3+ + e «Fe2+.
Необходимые для реакции электроны поставляет платина, в любом металле есть свободные электроны. Тогда платина будет положительно заряжена относительно раствора соли железа (III).
ε Fe3+/Fe2+ = εo Fe3+/Fe2+ + 0,059lg (C Fe3+/ C Fe2+).
Если погрузить платину в раствор восстановителя, она будет заряжена отрицательно относительно такого раствора, поскольку платина будет принимать на себя электроны от восстановителя, например двухвалентного олова:
( ─ ) Pt | Sn2+ Sn4+ + 2e «Sn2+.
Потенциалы таких систем называют red-ox- потенциалами. Это количественная характеристика силы окислителя или восстановителя. Чем больше red-ox- потенциал, тем выше окислительная способность. С восстановительной активностью наоборот. Можно по другому: в любой паре веществ партнер с большим red-ox- потенциалом будет выступать в роли окислителя. В табл.7.1 приведены значения потенциалов некоторых red-ox-систем.
Таблица 7.1
Окислительно-восстановительные потенциалы
| Форма | Электродная реакция | εo, В | |
| окисленная | восстановленная | ||
| Cr 3+ | Cr 2+ | Cr 3+ + e «Cr 2+ | ─ 0,41 |
| Cu2+ | Cu+ | Cu2+ + e «Cu+ | ─ 0,17 |
| Sn 4+ | Sn 2+ | Sn 4+ + 2e «Sn 2+ | + 0,15 |
| OH─ | O2 | H2O + 1/2O2 + 2e «4OH─ | +0,40 |
| Fe3+ | Fe2+ | Fe 3+ + e «Fe 2+ | + 0,77 |
| H2O | O2 | 1/2O2 + 2H+ + 2e «H2O | +1,23 |
| Cr2O72─ | Cr3+ | Cr2O72─ + 14H+ + 6e «2 Cr3+ + 7 H2O | +1,33 |
| CI─ | CI2 | CI2 + 2e «2CI─ | +1,36 |
Двухэлектродные системы
Двухэлектродная обратимая система, в которой энергия химической реакции преобразуется в электрическую, называется гальваническим элементом. Первый химический источник тока создал Вольт. Медную и цинковую пластины он соединил тканью, пропитанной раствором серной кислоты:
(─) Zn| H2SO4 | Cu (+)
(─) Zn ─ 2e → Zn 2+
(+) 2H+ + 2e → H2 ↑.
Из-за выделения газообразного водорода такая система не получается обратимой, она работает только на разряд. Обратимость достигается в той же медно-цинковой основе при использовании электродов 1 рода (элемент Даниэля – Якоби):
|
|
|
Zn + CuSO4 «ZnSO4 + Cu
(─) Zn| ZnSO4 || CuSO4 | Cu (+)
(─) Zn ─ 2e «Zn 2+
(+) Cu2+ + 2e «Cu
Элемент изображен на рис.7.2. Электродов нужно обязательно два. Если просто погрузить металлический цинк в раствор сульфата меди, начнется обычная окислительно-восстановительная реакция с прямой передачей электронов от восстановителя (Zn) к окислителю (Cu2+), цепь отсутствует, электрического тока не получится. Цинк, как металл первой группы заряжен отрицательно относительно раствора своей соли, а медь – положительно. Медная и цинковая пластины соединены электрическим проводником (металлом), растворы солей цинка и меди соединяют также раствором электролита, обычно трубка, наполненная раствором хлористого калия, ее называют электролитическим ключом. Вот тогда поток свободных электронов начнет движение в направлении от цинка к меди (от минуса к плюсу).
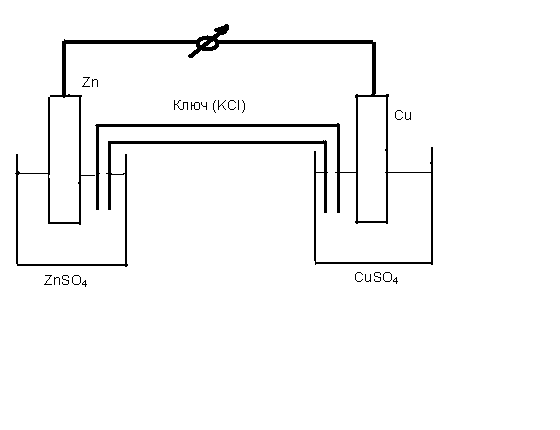
Рис. 7.2 Элемент Даниэля – Якоби
На цинковом электроде происходит реакция окисления цинка, а на медном электроде – реакция восстановления катионов меди.
Электрод, на котором протекает процесс окисления, называется анодом.
Электрод, на котором протекает процесс восстановления, называется катодом. В гальваническом элементе анод имеет знак «Минус», а катод – «Плюс».
Суммарная работа, производимая электрическим током называется электродвижущей силой (э.д.с.) элемента (Е). Проведем анализ всех видов работ. Необходимо выделить все границы раздела фаз, на которых происходят скачки потенциала.
А1 –работа окисления цинка (поверхность металлического цинка в контакте с раствором его соли). А1 = ─ εZn • n • F. Электродный потенциал цинка – это работа переноса одного электрона, n=2 и нужно еще привести к молю умножением на число Фарадея. Фактическое направление тока от цинка к меди противоположно принятому от «плюса» к «минусу», поэтому вводим знак «─»;
|
|
|
А2 – работа восстановления ионов меди (поверхность меди в растворе ее соли). А2 = εCu • n • F;
А3 – работа преодоления контактного потенциала (контакт цинка и меди с электрическим проводником – граница раздела двух металлов);
А4 – работа преодоления диффузионного потенциала (контакт растворов солей меди и цинка с раствором хлорида калия – граница раздела двух растворов).
Последние два вида работ невелики по абсолютной величине, и кроме того, они входят дважды – один раз с плюсом, а второй – с минусом. Таким образом, они элиминируют друг друга:
А3 = А4 ≈ 0.
Е • n • F = = εCu • n • F ─ εZn • n • F,
Е = εCu ─ εZn.
Медь – катод, цинк – анод. В общем случае э.д.с. гальванического элемента равна разности электродных потенциалов катода и анода:
Е = εкатода ─ εанода.
По своему физическому смыслу э.д.с. есть величина неотрицательная, в паре металлов катодом будет выступать тот металл, у которого потенциал больше: εкатода > εанода, при этом один и тот же металл может выступать как в роли анода, так и катода в зависимости от партнера.
При стандартных концентрациях растворов меди и цинка 1 моль/л, э.д.с. этого элемента составит:
Е = ε0Cu ─ ε0Zn = 0.337 ─ (─ 0,762) = 1,1В
Для достижения больших значений электродвижущих сил необходимо раздвигать в стороны пары металлов в ряду напряжений, например в системе магний – серебро разность потенциалов составит уже более 3В. Для получения еще больших значений э.д.с. собирают батарею элементов с их последовательным соединением.
Разность потенциалов между катодом и анодом образуется главным образом за счет природы металлов, их различных значений стандартных электродных потенциалов, но можно получить положительную э.д.с. и в случае одинаковых металлов. Для этого требуется градиент концентраций, например, собираем цепь из двух медных электродов с концентрациями ионов меди в растворах 1М на первом электроде и 0,01М на втором. Где анод?
(1) Cu| CuSO4 || CuSO4 | Cu (2)
(1) εCu = ε0Cu = 0,34В
(2) εCu = ε0Cu + (0,059/2) • lg 0,01 = 0,28В.
Анодом будет являться первый (левый) медный электрод, там потенциал меньше, потому что концентрация ионов меди меньше. Е = 0,06В.
Гальванический элемент, работающий за счет разности концентраций, называется концентрационным.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1749; Нарушение авторских прав?; Мы поможем в написании вашей работы!