
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ 3.Химическая кинетика и химическое равновесие
Термохимические законы. Рассмотрим основные законы термохимии, которые являются частными проявлениями закона сохранения и превращения энергии. Первый закон термохимии обычно формулируют следующим образом: Тепловой эффект прямой реакции равен по абсолютному значению и противоположен по знаку тепловому эффекту обратной реакции. Иначе говоря, осуществив в системе какой-либо химический процесс, а затем ему противоположный, мы возвращаем систему в первоначальное состояние с той же внутренней энергией, какую она имела.
При термохимических расчетах особенно важным является один из видов тепловых эффектов - теплота образования.
Теплотой образования называют тепловой эффект реакции образования одного моля химического соединения из простых веществ, устойчивых при данных условиях.
Например, теплота образования силиката кальция есть тепловой эффект реакции, равный 1635 кДж на 1 моль продукта:
Са + Si + 3/2О2 = СаSiO3 + 1635 кДж/моль
Будем в дальнейшем тепловой эффект реакции образования при стандартных условиях обозначать символом Q°298
Однако нужно понимать, что в термохимии и термодинамике приняты разные исходные положения для учета изменения энергии при химических реакциях. Термохимия, как было указано ранее, рассматривает, сколько энергии приобрела (или отдала) окружающая среда, в которой происходит химическая реакция. Термодинамика, напротив, учитывает изменения энергии, происходящие в самой реакции, т.е. при переходе исходных реагентов в продукты реакции. При этом в термодинамике тепловой эффект реакции образования, проводимой при постоянном давлении, обозначают символом DН°298 (энтальпия), который численно равен, но противоположен по знаку величине Q°298. Следовательно, эндотермическим процессам (-Q°298) соответствуют положительные значения DН°298, а экзотермическим (+Q°298) - отрицательные, т.е. - DН°298. Например, эндотермическая реакция паров воды с углем с учетом теплового эффекта может быть выражена двумя способами:
Н2О(г) + Ств = СО(г) + Н2(г) - 132 кДж/моль
Н2О(г) + Ств = СО(г) + Н2(г) (DН =132кДж/моль)
Оба способа записи термохимического уравнения химической реакции эквивалентны и показывают, что при взаимодействии паров воды с углем происходит поглощение теплоты.
Второй термохимический закон, открытый в 1840 г. известным русским химиком Гессом, является важнейшим и формулируется следующим образом: тепловой эффект химической реакции не зависит от пути ее протекания и определяется только начальным и конечным состоянием системы.
Например, силикат кальция можно получить двумя путями:
1) из простых веществ, сжигая эквимолярные количества кальция и кремния совместно в кислороде:
Са + Si + 3/2О2 = СаSiO3 (DН1)
2) из простых веществ, предварительно превращенных в оксиды:
Са + 1/2О2 = СаО (DН2)
Si + O2 = SiO2 (DН3)
с последующим взаимодействием оксидов:
СаО + SiO2 = СаSiO3 (DН4)
В соответствии с законом Гесса получается:
DН1 = DН2 + DН3 + DН4
Закон Гесса часто используют для определения тепловых эффектов, которые трудно или невозможно измерить непосредственно.
Важным следствием закона Гесса является правило, согласно которому тепловой эффект реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ.
DН°x.p. = SН°обр (продуктов) - SН°обр (реагентов) (4)
Суммирование следует производить с учетом количества вещества, участвующего в реакции, т.е. с учетом стехиометрических коэффициентов в уравнении, например:
Fе2О3 + 3СО = 2Fе + 3СО2 (DН°)
DН° = 3DН°CO2 – DН°Fe2O3 – 3DН°CO
Теплота образования всех простых веществ принята равной нулю.
Знание теплот образования веществ и тепловых эффектов реакций позволяет делать приближенные, но очень важные выводы.
Во-первых, чем больше по абсолютному значению экзотермический эффект образования соединения, тем оно термически устойчивее.
Во-вторых, эндотермические и слабоэкзотермические соединения являются, как правило, химически малоустойчивыми и обладают более высокой реакционной способностью, чем сильно экзотермические вещества.
Наконец, необходимо подчеркнуть, что значения тепловых эффектов реакций образования химических соединений, как и другие их свойства, находятся в периодической зависимости от атомных номеров элементов, образующих эти химические соединения.
Направление протекания химических реакций. Из анализа энергетики химических взаимодействий непосредственно следует еще более важный вывод о принципиальной возможности прогнозирования многих химических реакций. Свыше 100 лет назад основой для таких прогнозов служил принцип Бертло-Томсена, согласно которому химический процесс осуществляется лишь в том случае, если он сопровождается выделением теплоты, т.е. является экзотермическим. Однако на практике оказалось, что многие эндотермические реакции довольно легко осуществляются при повышенных температурах.
Теперь известно, что, помимо стремления к минимуму энергии, в физико-химических системах существует еще одна тенденция - стремление к увеличению беспорядка.
Стремление к переходу в наиболее вероятное состояние характерно для всех систем. Количественной мерой беспорядка системы (неупорядоченности состояния системы) является величина S, называемая энтропией. Таким образом, с учетом вышесказанного энтропия увеличивается при расширении, плавлении веществ и т.д. Кроме того, энтропия возрастает при переходе вещества из кристаллического состояния в газообразное (Sг>>Sж>Sтв). Величина энтропии, аналогично энтальпии, не зависит от пути протекания реакции и определяется только начальным и конечным состоянием системы, т.е. является функцией состояния системы. Более того, для расчета изменения энтропии при химической реакции также применимы соотношения, аналогичные законам Гесса и следствиям из них:
DS°x.p. = SS°обр (продуктов) - SS°обр (реагентов) (5)
Важной характеристикой состояния системы является общая энергия системы, называемая энергией Гиббса (свободной энергией системы) и определяемая соотношением:
G = H – TS (6)
Являясь функцией состояния системы, также как энтальпия и энтропия, энергия Гиббса при протекании химической реакции определяется следующим образом:
DGx.p. = DНx.p. – ТDSx.p. = SDGобр (продуктов) - SDGобр (реагентов) (7)
Важным свойством энергии Гиббса является ее способность определять направление протекания химического процесса.
Если изменение энергии Гиббса химической реакции меньше нуля (DG<0), то при отсутствии внешних воздействий в нормальных условиях процесс протекает в сторону образования продуктов реакции.
Если же это изменение является положительной величиной (DG>0), то процесс может протекать в сторону образования исходных веществ.
Из условия DG=0 (состояние равновесия) можно рассчитать равновесные количества веществ, находящихся в равновесном состоянии.
При планировании и оптимизации химического технологического процесса необходимо знать не только его энергетические параметры, но также и кинетические закономерности. Основным понятием в химической кинетике является понятие о скорости реакции: скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени. Если при неизменных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за промежуток времени от t1 до t2, то в соответствии с определением скорость реакции за данный промежуток времени равна:
v = dc/dt (8)
За скоростью протекания реакции можно проследить, непосредственно измеряя концентрацию реагентов или продуктов через определенные промежутки времени. Иногда о скорости взаимодействия судят по изменению других свойств системы, если эти свойства изменяются пропорционально концентрации, например изменение:
а) окраски: N2О4 «2NO2
б) объема или давления: N2О5(тв) «2NО2(г) + 1/2О2
в) массы твердого продукта: СаСО3 = СаО + СО2 и т. п.
Скорость химической реакции зависит от многих факторов, включая природу реагентов, концентрацию реагирующих веществ и температуру, наличие катализаторов, состояние кристаллической решетки твердых реагентов и продуктов, если такие имеются в системе. Рассмотрим эти факторы.
Влияние концентрации реагентов может быть объяснено на основе представлений, согласно которым химическое взаимодействие является результатом столкновения частиц реагирующих веществ. Увеличение числа частиц в данном объеме приводит к более частым их столкновениям, т. е. к увеличению скорости реакции. Если при химическом взаимодействии сталкиваются частицы нескольких видов, то число таких столкновений пропорционально произведению концентраций этих частиц.
Влияние концентрации реагентов на скорость химического взаимодействия выражается основным законом химической кинетики – кинетическим законом действующих масс.
Скорость элементарной стадии химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Любая химическая реакция может быть представлена как совокупность соответствующих элементарных стадий.
Скорость простой реакции А + В → АВ равна:
v = k сА сB (9)
B более общем случае для скорости простой реакции аА + bB → dD имеем:
v = k caA cbB (10)
Формулы (9) и 10) называют уравнениями кинетического закона действующих масс, в которых k - константа скорости. Физический смысл константы скорости можно установить, если принять, что сА = сВ = 1 моль/л. Тогда k = v, т. е. константа скорости численно равна скорости, с которой реагируют вещества при их концентрации (или произведении концентраций), равной единице.
Зависимость скорости реакции от концентрации реагентов, выражаемая основным законом химической кинетики, распространяется на газовые смеси и растворы, но она неприменима к реакциям с участием твердых фаз. В последнем случае реакция развивается более сложным образом.
Многочисленные опыты показывают, что при повышении температуры скорость большинства химических реакций существенно увеличивается, причем для реакций в гомогенных системах при нагревании на каждые десять градусов скорость реакции возрастает в 2-4 раза (правило Вант-Гоффа). Как объяснить столь высокую температурную чувствительность скорости реакции? С первого взгляда может показаться, что она связана с увеличением числа молекулярных столкновений. Однако это не так. Согласно расчетам общее число столкновений молекул при повышении температуры на десять градусов возрастает только на 1,6%, а число прореагировавших молекул возрастает на 200-400%.
Чтобы объяснить наблюдаемые расхождения, Аррениус предположил, что влияние температуры сводится главным образом к увеличению числа активных молекул, т.е. молекул, столкновение которых приводит к образованию продукта (эффективные столкновения). Согласно Аррениусу, константа скорости реакции экспоненциально изменяется с температурой:
k = A exp (-EA/RT) (11)
В уравнении (11) фигурирует величина ЕA, имеющая размерность энергии (Дж/моль) и названная энергией активации, R - молярная газовая постоянная, равная 8,31 Дж/(моль.К). Энергия активации - это энергия, необходимая для эффективного столкновения. Естественно, что она в большинстве случаев больше, чем средняя энергия молекул.
Энергию активации можно рассчитать, измерив константы скорости реакции при разных температурах, по уравнению
lg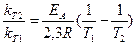 (12)
(12)
Различие между энергией активации и тепловым эффектом реакции А + В = АВ иллюстрирует приведенная выше схема. Сама энергия активации обусловлена энергетическим барьером, который следует преодолеть сталкивающимся молекулам в прямом или обратном направлениях, прежде чем произойдет перераспределение связей.
Катализ. Одно из наиболее эффективных средств воздействия на скорость химических реакций - использование катализаторов. Катализаторы - это вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменными как по составу, так и по массе. Иначе говоря, в момент самой реакции катализатор активно участвует в химическом процессе, как и реагенты. Роль катализатора заключается в увеличении скорости реакции, хотя некоторые вещества при добавлении их в систему не ускоряют, а замедляют процесс. Явление ускорения химических реакций благодаря присутствию катализаторов носит название катализа, а замедления - ингибирования. Катализ - очень важный раздел химии и химической технологии. С некоторыми катализаторами вы ознакомитесь при изучении конкретных технологических процессов.
Существуют два вида катализа: гомогенный и гетерогенный. При гомогенном катализе реагенты, продукты и катализатор составляют одну фазу (газовую или жидкую). В этом случае отсутствует поверхность раздела между катализатором и реагентами. Особым случаем катализа является так называемый аутокатализ. Смысл его заключается в том, что процесс ускоряется одним из продуктов реакции.
Многие реакции в растворах ускоряются ионами гидроксония Н3О+ (в кислой среде) и ионами ОН- (в щелочной). К ним относят гидролиз крахмала, омыление эфиров, гидролиз сахарозы и др. Иногда катализирующее действие в растворах оказывают ионы NН4+, НСО3-, СН3СОО-, сильно ускоряющие некоторые реакции с участием органических молекул. Особенность гетерогенного катализа состоит в том, что катализаторы (обычно твердые вещества) находятся в ином фазовом состоянии, чем реагенты и продукты реакции. Реакция развивается на поверхности твердого тела, которая всегда имеет много дефектов, в том числе свободные электронные пары, не участвующие в образовании связи. Молекулы реагентов легко взаимодействуют с этими электронами и благодаря образующимся связям удерживаются на поверхности катализатора. В результате некоторые связи внутри адсорбированных молекул настолько ослабевают, что молекулы либо разрушаются, либо превращаются в более активные промежуточные продукты. Каталитическая активность твердого вещества тем выше, чем лучше реагенты адсорбируются на его поверхности, и чем слабее продукты реакции удерживаются ею. При этом важно, чтобы, изменяя энергетическое состояние молекул реагента, катализатор сам не образовывал с ними прочных химических связей.
В заключение этого раздела отметим, что согласно современным воззрениям каталитическая активность твердого тела обусловлена не всей поверхностью, а лишь отдельными ее частями, называемыми активными центрами. Их природа пока точно не установлена. Как правило, твердый катализатор стремятся получать с максимально большой поверхностью. Однако площадь ее сама по себе еще не определяет эффективности катализатора. Более важно состояние поверхности, т.е. число активных центров на единицу поверхности.
Химическое равновесие. До сих пор мы рассматривали химические реакции, условно полагая, что они идут до конца, т. е. реагенты полностью превращаются в продукты реакции. В действительности же такое положение справедливо лишь для некоторых реакций, называемых необратимыми. Примером практически необратимых реакций могут служить реакции термического разложения, реакции в растворах, сопровождающиеся образованием газообразного или труднорастворимого продукта, и др.:
СаСО3 = СаО + СО2
ВаСl2 + Н2SО4 = ВаSО4¯+ 2НСl
NaНСО3 + НСl = NaСl + Н2О + СО2
Большинство химических процессов является обратимыми, и по мере их протекания в системе создаются условия для противоположных изменений.
Рассмотрим более подробно процессы, протекающие в обратимых системах. В качестве примера возьмем некоторую простую реакцию:
аА + bB ↔ сС + dD
Если система первоначально состоит из чистых реагентов, то согласно основному закону химической кинетики скорость взаимодействия выражается соотношением:
v1 = k1 caA cbB (13)
По мере химического превращения концентрации веществ А и В уменьшаются и, следовательно, скорость прямой реакции понижается. Вместе с тем появление в системе продуктов означает возможность протекания обратной реакции, скорость которой v2 = k2 ccC cdD непрерывно возрастает.
Рано или поздно будет достигнуто состояние, при котором скорости прямой и обратной реакций сравняются. Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием. Концентрации реагентов и продуктов, отвечающие состоянию равновесия, называют равновесными и обозначают символами: [А], [В], [С] и [D].
Так как в состоянии равновесия v1 = v2, то
k1 [А]a [В]b = k2 [С]с [D]d. (14)
Следовательно,
Kр = 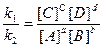 (15)
(15)
Отношение констант скоростей прямой и обратной реакций является также постоянной величиной, получившей название константы химического равновесия. Подобно константам скорости прямой и обратной реакций, константа химического равновесия тоже зависит от температуры. Уравнение (13) является математическим выражением равновесного закона действующих масс и справедливо для разбавленных растворов. Константа равновесия представляет постоянную величину независимо от тех условий, при которых осуществляется реакция, если только температура остается постоянной.
Константа равновесия связана со свободной энергией системы следующим соотношением:
-RT ln Kp = DGT° (16)
Зная константу равновесия при двух разных температурах, можно вычислить стандартную энтальпию реакции по формуле:
lg (17)
(17)
Состояние химического равновесия при неизменных внешних условиях может сохраняться сколь угодно долго. Как только в системе нарушается равновесие, скорости прямой и обратной реакций становятся неодинаковыми, и в системе преимущественно протекает процесс, который опять приводит ее к состоянию равновесия, но уже отвечающему новым условиям. Изменения, происходящие в равновесной системе в результате внешних воздействий, определяются принципом подвижного равновесия - принципом Ле Шателье.
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Принцип Ле Шателье универсален, так как применим не только к чисто химическим процессам, но и к физико-химическим явлениям, таким, как кристаллизация, растворение, кипение, фазовые превращения в твердых телах. Рассмотрим применение принципа Ле Шателье к различным типам воздействия.
Влияние изменения температуры. При повышении температуры ускоряются как прямая, так и обратная реакции, но в разной степени. Как правило, эндотермический процесс ускоряется в большей степени, чем экзотермический. При понижении температуры в системе из двух реакций быстрее протекает экзотермическая. Следовательно, для выяснения влияния температуры на химическое равновесие необходимо знать и значение теплового эффекта реакции. Чем больше тепловой эффект реакции, тем сильнее влияние температуры.
Влияние изменения давления. При повышении давления равновесие реакции смещается в направлении образования веществ, занимающих меньший объем, и, наоборот, понижение давления способствует процессу, сопровождающемуся увеличением объема.
В реакции синтеза аммиака из азота и водорода повышение давления способствует накоплению аммиака, так как при реакции из каждых четырех молей газа (1 моль N2 и 3 моль Н2) образуются два моля газа (NН3). При этом объем газа уменьшается вдвое.
Влияние изменения концентрации. Если к системе, находящейся в состоянии равновесия, прибавлять дополнительные количества одного из веществ, участвующих в реакции, то скорости прямого и обратного процессов изменятся, но таким образом, что система снова придет в состояние равновесия. В этом новом состоянии концентрации всех веществ будут отличаться от первоначальных, но соотношение между ними (определяемое константой равновесия) останется прежним. Иначе говоря, в равновесной системе, нельзя изменить концентрацию только одного из веществ, не вызывая изменений концентраций всех остальных.
В соответствии с принципом Ле-Шателье в системе развивается процесс, уменьшающий концентрацию дополнительно вводимого вещества.
ЛЕКЦИЯ 4. Общие принципы расчета процессов и аппаратов.
Для оценки состояния равновесия в реакторе обычно используют равновесную степень превращения (равновесный выход продукта).
Равновесной степенью превращения (Х*) называется степень превращения исходных веществ в продукты реакции, отвечающая состоянию устойчивого равновесия системы. Равновесная степень превращения характеризует глубину протекания процесса, степень приближения его результатов к оптимальным в данных условиях. Она функционально связана с константой равновесия.
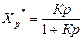 (1)
(1)
Имейте в виду, что Кр для электрохимических процессов имеет вид:
 (2)
(2)
Зависимость между константой равновесия и равновесной степенью превращения является одной из важнейших в химической технологии, так как последняя характеризует условия максимально возможного извлечения целевого продукта из сырья. Смещение равновесия в сторону образования целевого продукта может быть достигнуто изменением температуры, давления и концентраций реагентов и продуктов реакции.
Знание равновесной степени превращения и ее зависимости от различных факторов химического процесса позволяет рассчитывать равновесный состав продуктов процесса, оценивать влияние различных условий на состояние равновесия системы в химическом реакторе, определять тепловой режим и другие параметры процесса.
Для начала определяют условия равновесия (vпр=vобр) и направления протекания процесса (∆Gх.р.<0). На основании данного равновесия рассчитывают начальные и конечные значения параметров процесса (функции состояния системы - ∆G, ∆Н, ∆S). Термодинамические функции дают теоретическое обоснование возможности протекания процесса. Оптимальные условия проведения реакции находят путем математического моделирования процесса на основании данных, полученных при изучении кинетики.
Для определения расхода сырья и вспомогательных веществ, выхода продуктов и производственных потерь составляют материальный баланс на основе законов сохранения материи и стехиометрических соотношений взаимодействующих веществ.
Приход вещества – расход вещества = накопление вещества (3)
В стационарном режиме проведения процесса (скорость образования ≈ скорость расходования) не происходит накопления вещества, и уравнение (3) переходит в уравнение (4):
Приход вещества = расход вещества (4)
Материальный баланс составляют для всех веществ, участвующих в ХТП. Материальный баланс отражает степень совершенствования технологического процесса и состояние производства. Чем полнее составлен материальный баланс, тем меньше производственных потерь и побочных веществ, т.е. тем выше выход и селективность получаемого продукта.
На основании тепловых эффектов химических реакций, т.е. ∆Н, и закона сохранения энергии составляют энергетический баланс:
Приход тепла – расход тепла = накопление тепла (5)
Для стационарного режима:
Приход тепла = расход тепла (6)
Тепловой баланс составляют для определения потребности в топливе, величины теплообменных поверхностей, а также расхода теплоносителя и хладагента.
Тепловой баланс составляют на основании материального баланса, теплового эффекта реакции и подвода и отвода тепла в системе. Тепловой баланс составляется для определения потребности в топливе, теплообменах поверхностей, расходы теплоносителя и хладоагента.
Далее находят движущую силу процесса – это разность между предельным численным значением параметра и его действительным (рабочим) параметром.
Как мы видим для того, чтобы практически овладеть основами прогрессивных технологий, необходимо знать теоретические основы протекающих химических процессов.
Теоретические основы протекающих химических процессов сводятся к 3ем составным частям:
1. структурный подход;
2. термодинамический подход: направление протеканий химических реакций и энергии;
3. кинетический подход: изучение конкретных условий протекания процессов, их механизм и скорость протекания.
Водоподготовка. Большинство технологических процессов проводят с использованием воды в качестве растворителя. Следовательно, для приведения качества воды в соответствие с требованиями технологии необходимо проводить комплекс процессов переработки и очистки воды. В список этих мер входят: обеззараживание, обессоливание, умягчение воды.
Из реагентных методов умягчения воды наиболее распространен известково-содовый способ. Он основан на введении в воду веществ, обогащающих ее карбонат- и гидроксид-ионами, в результате чего образуются труднорастворимые соли кальция и магния, выделяемые из воды осаждением и фильтрованием.
Однако, например, для производства полимеров необходима повышенная чистота воды, которую не обуславливает ни дистилляция, ни известковый метод. Современный метод очистки воды состоит в пропускании ее через ионообменники. Среди ионообменных смол выделяют катиониты и аниониты. В результате катионирования воды ионы Сa2+ и Mg2+ обмениваются на ионы катионита. Катионит регенерируют растворами солей, содержащих катионы Na+ или NH4+, либо кислотами, протоны которых вытесняют поглощенные ионы кальция и магния.
Аниониты, соответственно, обменивают анионы, содержащиеся в очищаемой воде, например, гидроксид-ионы.
Промышленный катализ. Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов.
Идея использования катализа для расщепления углеводородов нефти до низкомолекулярных продуктов, обладающих более низкой температурой кипения, появилась еще в 1927 г. Но только спустя десять лет была построена первая в мире промышленная установка каталитического крекинга с применением в качестве катализатора соединений окиси кремния и окиси алюминия (алюмосиликата). После 1937 г. в нефтяную промышленность прочно вошли каталитические способы переработки нефти, включающие в себя множество разнообразных химических процессов. К основным из относятся: расщепление углерод-углеродных связей и изомеризация первичных продуктов расщепления (крекинг); дегидрирование и изомеризация углеводородов с образованием разветвленных и ароматических молекул; гидрирование ненасыщенных углеводородов с повременным удалением серы и азота в виде сероводорода и аммиака (гидроочистка); введение углеводородных фрагментов в бензольное кольцо ароматических соединений (алкилирование).
При этом получают более высокооктановое топливо и ароматические углеводороды, которые могут быть использованы для дальнейшей химической переработки. Примерно одну треть моторного топлива в мире получают путем крекинга. При этом следует отметить, что более четверти всей мировой химической продукции вырабатывают из разных видов продуктов химической переработки нефти.
Применение катализа необычайно широко и разнообразно и охватывает поле деятельности исследователей многих профилей и направлений.
Например, существует проблема «фиксации» азота воздуха - чрезвычайно инертного вещества, которое даже с кислородом реагирует лишь при 3500-4000°С. Природные ресурсы связанного азота ограничены, тогда как для производства продуктов сельского хозяйства необходимы огромные количества соединений азота. Ресурсы же свободного азота практически неограниченны. Химики переводят его в связанное (и более реакционноспособное) состояние с помощью реакции
N2 + 3Н2 = 2NH3.
Чтобы скорость этой реакции была приемлема с практической точки зрения, нужны высокие температура и давление. Однако с ростом температуры равновесие реакции постепенно смещается в сторону образования исходных веществ. С другой стороны, чем ниже температура и чем полнее протекает реакция образования аммиака, тем более заметно снижается скорость процесса. Поиск компромисса между действующими в разные стороны факторами привел Габера (1907) к созданию промышленного способа превращения азотоводородной смеси в аммиак при 500° С и 300 атм. Сейчас это главный способ получения аммиака, который широко используется в производстве удобрений, азотной кислоты (каталитическое окисление аммиака над платиной), аммониевых солей, соды, синильной кислоты и т. д.
С помощью катализа осуществляют гидрогенизацию ненасыщенных химических соединений. Так, обрабатывая окись углерода водородом в присутствии цинк-хромовых катализаторов при 400° С и давлении около 300 атм, получают метанол CO+2H2 = СН3ОН, широко используемый в качестве растворителя исходного продукта для производства других ценных веществ. В частности, окисляя его на серебряном или медном катализаторе, можно получить формальдегид
2СН3ОН + О2 = 2HСОН + 2Н2О
не менее важное вещество, в больших количествах потребляемое для синтеза пластических масс.
В результате обработки растительных масел водородом в присутствии никелевых катализаторов образуются твердые жиры (в частности, маргарин). При обработке кислотой растительного сырья (древесные отходы, подсолнечная лузга, солома и т. п.) происходит расщепление полисахаридных цепей (целлюлозы, пентозанов) с образованием пищевых и кормовых продуктов, глюкозы, ксилозы, фурфурола и целого ряда других кислородсодержащих производных. При совмещении процессов кислотного гидролиза и каталитической гидрогенизации (так называемого гидрогенолиза), проводимых в более жестких условиях (200°С, 50атм), получают продукты глубокого расщепления молекулярных цепей глицерин, этиленгликоль, пропиленгликоль. Эти вещества используются в производстве взрывчатых веществ, глифталевых смол, а также пластификаторов и растворителей.
Нельзя обойти молчанием производство полимеров и синтетических волокон. Здесь гордостью отечественной науки является разработанный С. В. Лебедевым (1932) процесс получения синтетического каучука по схеме: этиловый спирт - бутадиен - полибутадиен. Каталитические реакции в этом процессе осуществляются на первой стадии - дегидрогенизации и одновременной дегидратации этилового спирта. Сейчас бутадиен и изопрен получают также путем дегидрогенизации углеводородов нормального строения на алюмохромовых катализаторах, в частности из бутана. Это позволило вовлечь в производство синтетического каучука природные ресурсы газа и газы, отходящие при переработке нефти.
Большим событием в производстве полимеров явилось открытие стереоспецифической полимеризации ненасыщенных соединений в присутствии смешанных катализаторов Циглера - Натта (1952). Примером этого типа катализаторов может служить смесь триэтилалюминия и четыреххлористого титана. Применение этих катализаторов дало возможность получать макромолекулы с определенной пространственной конфигурацией мономерных звеньев. Изделия из таких полимеров обладают прекрасными эксплуатационными свойствами.
Производство высокомолекулярных соединений. Полимеры – это высокомолекулярные соединения, состоящие из периодически повторяющихся звеньев (мономеров), соединенных друг с другом ковалентными связями.
Природные полимеры образуются в процессе биосинтеза в клетках живых организмов. С помощью экстракции, фракционного осаждения и других методов они могут быть выделены из растительного и животного сырья. Синтетические полимеры получают полимеризацией и поликонденсацией. Карбоцепные полимеры обычно синтезируют полимеризацией мономеров с одной или несколькими кратными углеродными связями или мономеров, содержащих неустойчивые карбоциклические группировки (например, из циклопропана и его производных).
|
|
Дата добавления: 2014-01-04; Просмотров: 894; Нарушение авторских прав?; Мы поможем в написании вашей работы!