
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектр атома водорода по Бору
|
|
|
|
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем. Систем, состоящих из ядра с зарядом Ze и одного электрона (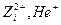 ).
).
Получено выражение для радиуса стационарной орбиты 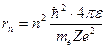 ,
,
для атома водорода Z=1 при n=1 радиус первой орбиты электрона
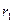 = a =
= a = 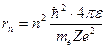 = 0,528
= 0,528 м.
м.
Проверить эти теоретические расчеты возможно с помощью измерения излучаемой и поглощаемой энергии, получаем 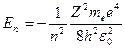 ,
,
где знак “ - “ показывает, что электрон находится в связанном состоянии.
Согласно второму постулату Бора при переходе атома водорода (Z=1) из стационарного состояния n с большей энергией в стационарное состояние с меньшей энергией испускается квант 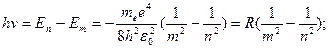

эта величина в точности совпадает с величиной постоянной Ридберга, определяемой экспериментально в эмпирической формуле для атома водорода в формуле Бальмера
Бальмер разобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра
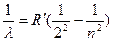 n=3,4,5...
n=3,4,5...
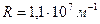 -постоянная Ридберга
-постоянная Ридберга
Так как  , то
, то  , где
, где 
Отсюда следует, что спектральные линии, отличающиеся значениями n, образуют группу или серию линий называемую серией Бальмера (в видимой области спектра)
Далее в спектре атома водорода было обнаружено несколько серий
В ультрафиолетовой области спектра
Серия Лаймана 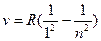 (n=2,3,4,…)
(n=2,3,4,…)
В видимой области спектра
Серия Бальмера  (n=3,4,5,…)
(n=3,4,5,…)
В инфракрасной области спектра
Серия Пашена 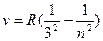 (n=4,5,6,…)
(n=4,5,6,…)
Серия Брэкета  (n=5,6,7,…)
(n=5,6,7,…)
Серия Пфунда  (n=6,7,8,…)
(n=6,7,8,…)
Серия Хэмфри 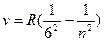 (n=7,8,9,…)
(n=7,8,9,…)
Эти формулы подобраны эмпирически, подтверждены экспериментально, но не имели теоретического обоснования. Вид формул повторяемость в них целых чисел, универсальность постоянной Ридберга наводит на мысль о глубоком физическом смысле этих закономерностей, не объяснимых в рамках классической физики.
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 274; Нарушение авторских прав?; Мы поможем в написании вашей работы!