
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа
|
|
|
|
В общем случае тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на химической реакции обычно пренебрегают; влияние температуры на величину теплового эффекта описывается формулой Кирхгофа. Имея в виду в первую очередь зависимость H = f(T), рассмотрим изменение энтальпии в ходе некоторой реакции
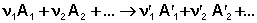
Каждому из участников реакции присуще определённое мольное значение энтальпии H i, суммирующееся из мольной внутренней энергии U i и произведения давления на молярный объём P V i. Тогда тепловой эффект реакции можно представить в виде алгебраической суммы:
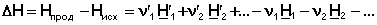 (34)
(34)
Для нахождения зависимости H = f(T) продифференцируем уравнение (34) по температуре при постоянном давлении:
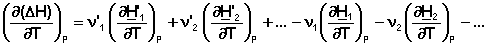 (35)
(35)
Производная мольной энтальпии вещества по температуре при P = const представляет собой мольную теплоёмкость этого вещества при постоянном давлении:
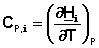 (36)
(36)
Поэтому
 (37)
(37)
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции.
Разделив переменные в уравнении (37) и проинтегрировав его, получаем:
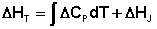 (38)
(38)
Здесь ΔHJ – постоянная интегрирования. При определённом интегрировании от Т1 до Т2 получим:
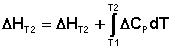 (39)
(39)
Если считать ΔСP не зависящим от температуры, уравнение (39) преобразуется к виду:
 (40)
(40)
Поскольку обычно известны табличные значения стандартных тепловых эффектов ΔН°298, преобразуем выражение (40):
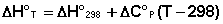 (41)
(41)
Для более точных расчётов необходимо учитывать зависимость молярных теплоёмкостей от температуры. Поскольку теория теплоёмкости до настоящего времени окончательно не разработана, для описания температурной зависимости теплоёмкостей веществ используются эмпирические формулы, представляющие теплоёмкости в виде степенного ряда:
|
|
|
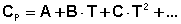 (42)
(42)
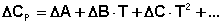 (43)
(43)
С учётом зависимости СР = f(Т) уравнения (38) и (40) преобразуются к виду:
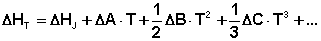 (44)
(44)
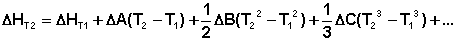 (45)
(45)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 437; Нарушение авторских прав?; Мы поможем в написании вашей работы!