
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Прямая потенциометрия
Метод основан на непосредственной зависимости потенциала индикаторного электрода от активности определяемых ионов в растворе, которая описывается уравнением Нернста:
Еи.э.= Е0 + 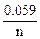 lg ax
lg ax
Для выполнения анализа необходимо иметь: систему электродов, потенциометр и исследуемый раствор.
Метод прямой потенциометрии, где индикаторным электродом служит ионоселективный электрод, называется ионометрией. Электродом сравнения служит хлоридсеребряный электрод. Ионометрию от других физико-химических методов анализа отличает простота методик и относительная дешевизна измерительных приборов.
 Уравнение для метода прямой потенциометрии, связывающее величину измеренного равновесного потенциала индикаторного электрода Еи.э. и активность определяемых ионов можно получить, решая систему уравнений:
Уравнение для метода прямой потенциометрии, связывающее величину измеренного равновесного потенциала индикаторного электрода Еи.э. и активность определяемых ионов можно получить, решая систему уравнений:
Еи.э. = Еэ.ср. – Еи.
Еи.э. = Е0исэ + S lg ax
где Еи – измеренный потенциал или ЭДС гальванического элемента; Еэ.ср. – потенциал электрода сравнения; S – угловой коэффициент (крутизна) электродной реакции; Е0исэ – стандартный потенциал ионоселективного электрода.
S = 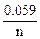
Решая систему уравнения, получим:
рХ = – lg ax = 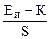 ,
,
где К = Еэ.ср. – Е0исэ.
Существует три приема выполнения ионометрического анализа:
1. Метод градуировки электрода. Это самый быстрый и простой метод. чтобы оценить К нужно лишь измерить потенциал электрода в растворе с известной концентрацией определяемого иона. Градуировку электрода выполняют по буферным растворам. Но этот метод имеет существенный недостаток: необходимо принимать найденную по уравнению ах равной концентрации, т.к. μ и fа неизвестны. Также необходимо полагать, что К неизменна во всех случаях, а это весьма спорно. Поэтому по точности он уступает следующим приемам.
2. Метод градуировочного графика. Для серии стандартных растворов измеряют ЭДС гальванического элемента при постоянной ионной силе раствора. Для этого во все стандартные, а также анализируемые растворы вводят одинаковый избыток индифферентного электролита. Можно полагать, что ионная сила всех растворов одинакова (μ=const) и считать, что
Еи.э. = Е0исэ + S lg Cx.
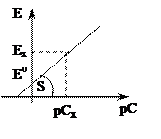
| В соответствии с этим уравнением график в координатах Е = f(– lg Сх) линеен и описывается уравнением прямой. Направление изменения потенциала индикаторного электрода зависит от потенциала электрода сравнения. |
3. Метод добавок является оптимальным, особенно в случае анализа растворов сложного состава или при анализе очень разбавленных растворов. Метод основан на измерении потенциала индикаторного электрода в анализируемом растворе и после введения известного объема стандартного раствора (или известного количества стандартного вещества).
В качестве индикаторных электродов в методе прямой потенциометрии применяются ионоселективные электроды, потенциал которых зависит от концентрации одного определенного иона. В качестве электродов сравнения применяют электроды II рода.
Метод прямой потенциометрии широко применяется для определения рН растворов.
Электрохимическая цепь при измерении рН:
Аg/AgCl/ 0,1 моль/дм3 р-р HCl// стекло(мембр.)// исслед. р-р// KCl(нас.)/ AgCl/Аg
|
|
Дата добавления: 2014-01-04; Просмотров: 2513; Нарушение авторских прав?; Мы поможем в написании вашей работы!