
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Данные для пересчета
|
|
|
|
1 мэкв натрия =23,0 мг 1 г натрия =43,5 мэкв
1 мэкв калия =39,1 мг 1 г калия =25,6 мэкв
1 мэкв кальция =20,0 мг 1 г кальция =49,9 мэкв
1 мэкв магния =12,2 мг 1 г магния =82,0 мэкв
1 мэкв хлора =35,5 мг 1 г хлора =28,2 мэкв
1 мэкв гидрокарбоната =61,0 мг 1 г гидрокарбоната =16,4 мэкв
1 г хлорида натрия содержит 17,1 мэкв натрия и 17,1 мэкв хлора 1 г гидрокарбоната натрия содержит 11,9 мэкв натрия и 11,9 мэкв гидрокарбоната
1 г лактата натрия содержит 8,9 мэкв натрия и 8,9 мэкв лактата 1 г хлорида калия содержит 13,4 мэкв калия и 13,4 мэкв хлора 1 г гидрокарбоната калия содержит 10,0 мэкв калия и 10,0 мэкв гидрокарбоната
1 г однозамещенного фосфата калия (KH2PO4) содержит 7,4 мэко калия и 7,4 мэкв первичного фосфата
1 г двузамещенного фосфата калия (K2HPO4) содержит 11,5 мэкв калия и 11,5 мэкв вторичного фосфата
Внимание: мэкв не является мерой величины концентрации. Необходимо знать, в каком объеме жидкости находится данное количество мэкв (например, мэкв/л плазмы).
Пересчет мг/дл в мэкв/л
Если необходимо пересчитать мг/дл в мэкв/л, то используют следующую формулу: для катионов и анионов
мг/дл Х 10 Х валентность
мэкв/л = -----------------------------------------—----------------------------
относительная атомная или молекулярная масса (мг)
для белков
мэкв/л = г/дл Х 2,41
С учетом значений рН шлазмы более точный расчет (Неisler и Schorer) будет следующим:
мэкв/л = г/дл Х 1,04 (рН 5,08)
После введения системы единиц СИ концентрации катионов и анионов будут обозначаться в ммоль/л (1 ммоль = относительной атомной или молекулярной массе в мг). Для однозарядных ионов (например, Na+, K+) значения не изменяются (1 ммоль=1 мэкв), для многовалентных они будут другими (Са2+: 1 ммоль = 2 мэкв).
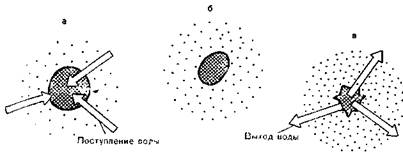
Рис. 5. Изменение объема эритроцитов в зависимости от осмотического давления растворов хлорида натрия различной концентрации.
а — гипотонический раствор хлорида натрия: набухание эритроцитов вплоть до разрыва (гемолиз); б — изотонический раствор хлорида натрия; в — гипертонический раствор хлорида натрия; сморщивание эритроцитов (форма сморщенного яблока).
Осмоляльность/Осмолярность
Осмоляльность означает осмотическое число на 1 кг растворителя, осмол яркость — на 1 л раствора.
Осмотическое давление раствора зависит от числа осмотически активных частиц (ионов и недиссоциированных молекул), которые находятся в определенном объеме.
Единица осмотического давления — осмоль или мосммоль (миллиосммоль). Если 1 моль глюкозы (относительная молекулярная масса 180,2; 1 моль= 180,2 г) находится в 1 кг воды, то этот раствор имеет «идеальную» осмоляльность, равную 1 осммоль. Если же внести в 1 кг воды 1 моль поваренной соли (относительная молекулярная масса = 58,4; 1 моль = 58,4 г), то образуется «идеальная» осмоляльность в 2 осммоль, так как поваренная соль распадается на ионы натрия и хлора, вследствие чего в растворе появляется удвоенное число частиц в отличие от глюкозы. В растворах, содержащих полностью диссоциирующие соли, осмотическое Давление упрощенно можно определить по числу катионов и анионов (так называемая идеальная осмоляльность). При этом, конечно, пренебрегают межионным взаимодействием, которое влияет на осмоляльность и ведет к «реальной» осмоляльности.
Осмотические соотношения ответственны за распределение воды,в различные жидкостные пространства в ортанизме (рис. 5, см. также 1.4.3).
Осмотическое давление определяют измерением снижения точки замерзания (осмометрия).
Осмоляльность плазмы
Осмоляльность плазмы составляет 290 мосммоль (кг воды 38 °С), (Geigy).
Плазма состоит в основном из диссоциирующих электролитов, при этом натрий по приближенному расчету определяет половину осмоляльности плазмы. Влияние неэлектролитов в нормальном состоянии незначительно: Глюкоза: 100 мг/дл = 5,5 мосммоль/л плазмы (Geigy) Мочевина: 100 мг/дл=17,2 мосммоль/л плазмы (Geigy) На основе этих представлений можно рассчитать осмоляльность плазмы, если известно количество натрия, мочевины и глюкозы (Mansberger et al.):
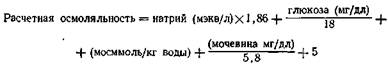
Различия между расчетной и измеренной осмоляльностью доказывают присутствие неизвестных растворенных веществ (токсины?) и служат показаниями для гемодиализа (Mans-berger и соавт.).
Низкая осмоляльность наблюдается только при гипона-триемии; гиперосмоляльное состояние, наоборот, многозначно (Mansberger et al.: гипернатриемия; гиперглюкоземия; уремия; неизвестные вещества; комбинация многих факторов).
Для практических целей из приведенных рассуждений можно сделать вывод, что концентрация натрия в плазме определяет ее осмоляльность. Отклонения наблюдаются особенно часто при диабете, уремии и в присутствии неизвестных растворенных веществ. В связи с этим точное измерение осмоляльности необходимо в каждом отдельном случае.
Эффективное осмотическое давление
Для определения отклонений в осмотическом давлении используют полупроницаемые мембраны. Вещества, частично проходящие через клеточные мембраны, например мочевина, вызывают отклонения осмотического давления только в тех количествах, которые препятствуют проницаемости клеточных мембран. Таким образом, эффективное осмотическое давление создается только истинными ионами.
Тоничность
Нормальная осмоляльность плазмы (290 мосммоль/кг воды) является отправной точкой для тоничности.
Изотоническими растворами являются (приближенно):
—1/6 молярные растворы солей, молекулы которых полностью диссоциируют на 2 иона, например 1/6 молярный раствор поваренной соли;
— 1/3 молярные растворы, если растворяемое вещество не диссоциирует, например 1/3 молярный раствор глюкозы.
Растворы, которые обнаруживают меньшую по сравнению c плазмой осмоляльность, яляются гипотоническими; растворы, обладающие более высокой осмоляльностью, являются гипертоническими.
Осмоляльность клетки соответствует таковой плазмы [Black, Moore, Burck, 1962]. При этом нужно учитывать, что часть электролитов в клетке остается недиссоциированной. На осмотическое давление в клетке постоянно влияет обмен веществ: при распаде больших молекулярных соединений на определенное количество более мелких осмоляльность повышается, при синтезе она снижается.
Коллоидно-осмотическое давление
Коллоидно-осмотическое давление соответствует степени участия белков в осмоляльности.
Так как белковые молекулы очень большие, число частиц на единицу маосы значительно меньше, чем в случае электролитов. Коллоидно-осмотическое давление плазменных белков составляет только 1,6 мосммоль/кг воды (25 мм рт. ст.). Это составляет 0,55% общей осмоляльности плазмы. Наибольший вклад вносит альбумин (85%, Geigy). Несмотря на малую величину осмоляльности плазмы, коллоидно-осмотическое давление имеет большое значение, потому что белки могут выходить из кровеносного русла только медленно. Из этого становится ясным влияние коллоидно-осмотического давления на распределение воды между плазмой и межтканевой жидкостью (см. 1.4.З.). Падение концентрации альбумина в плазме, например, снижает ее способность Удерживать воду (гипопротеинемический отек; восстановление объема циркулирующей крови).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1853; Нарушение авторских прав?; Мы поможем в написании вашей работы!