
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибридизация атомных орбиталей
Перестройка электронной структуры атома, представляет собой гибридизацию атомных орбиталей. Из исходных s-, p-, d-орбиталей (электронных облаков) образуются равноценные гибридные орбитали (электронные облака), вытянутые по направлению к соседним атомам. При этом обеспечивается более полное перекрывание с облаками этих соседних атомов, что приводит к выигрышу энергии, достаточному, чтобы с избытком компенсировать затраты на деформацию исходных электронных облаков.
sp-Гибридизация происходит у орбиталей атомов элементов II группы периодической системы Д.И. Менделеева, при образовании галогенидов. Атомы этих элементов в нормальном состоянии имеют во внешнем уровне два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в р-состояние, появляются два неспаренных электрона, один из которых s-электрон, другой р-электрон
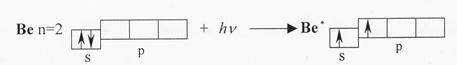
Энергия электронов р-подуровня выше, чем энергия электронов s-подуровня. Из исходных s- и р-орбиталей возбужденного атома бериллия (Be*) образуются две гибридные, одинаковые по энергии орбитали (облака) в форме неправильной гантели, расположенные под углом 180о друг к другу

При взаимодействии с р-орбиталями хлора, происходит перекрывание электронных облаков вдоль линии, соединяющей ядра взаимодействующих атомов. Форма молекул при sp-гибридизации линейная

sp2-Гибридизация происходит у орбиталей атома бора и его аналогов. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя р-электронами
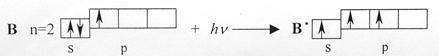
Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120о друг к другу
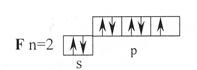
Электронно-графическая формула фтора
В образовании молекулы ВF3 участвуют 3 гибридных электронных облака атома бора и три р-электронных облака атома фтора. Форма молекул молекулы ВF3 – правильный треугольник на плоскости

sp3-Гибридизация характерна для атомов углерода и его аналогов – кремния, германия. Из одной s- и трех р-орбиталей атомов в возбужденном состоянии образуются четыре гибридных орбитали, расположенные под углом 109,5о друг к другу, они направлены к вершинам тетраэдра, в центре которого находится атом углерода; ребрами тетраэдра являются диагонали сторон куба

Молекула СН4 имеет форму тетраэдра, причем все четыре С-Н связи сигма (σ) равноценны
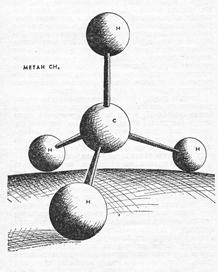
Пространственная структура СН4
В таблице даны типы гибридизации орбиталей и «архитектуры» молекул.
|
Дата добавления: 2014-01-04; Просмотров: 299; Нарушение авторских прав?; Мы поможем в написании вашей работы!