
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика
 |
Химия.
Преподаватель – Иванов Иван Иванович
Заведующая лабораторией – Королева Галина Борисовна
Слушатель – Никифоров Михаил Николаевич
АПМ-03 Курс 1. Семестр осенний. 2003 год.
Химия – наука о веществах, их строении, свойствах, превращениях, сопровождающихся изменением свойств веществ.
Превращения бывают: 1) Физические (процессы, сопровождаемые изменением физических свойств вещества). 2) Химические (сопровождаются изменением строения атомов и молекул, составляющих вещество. В результате образуются новые вещества с новыми свойствами. 2NaOH+H2SO4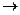 Na2SO4 + 2H20 + 113,7 Дж (нейтрализация) 3) Физико-химические (не сопровождаются коренной перестройкой атомов и молекул (плавление, испарение). 4) Ядерные (сопровождаются коренной перестройкой атомов, приводят к возникновению новых химических элементов)
Na2SO4 + 2H20 + 113,7 Дж (нейтрализация) 3) Физико-химические (не сопровождаются коренной перестройкой атомов и молекул (плавление, испарение). 4) Ядерные (сопровождаются коренной перестройкой атомов, приводят к возникновению новых химических элементов)
Химические процессы классифицируются: 1) Синтез (соединения): а) NH3+HCl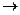 NH4Cl б) 2NO+O2
NH4Cl б) 2NO+O2 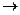 2NO2 2) Реакция разложения (анализа) а) (NH4)2+Cr2O2
2NO2 2) Реакция разложения (анализа) а) (NH4)2+Cr2O2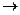 Cr2O3+N2+4H2O+Q 3) Реакция обмена. Pb(CH3COO)2+2KI
Cr2O3+N2+4H2O+Q 3) Реакция обмена. Pb(CH3COO)2+2KI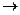 PbI2+2KCH3COO 4) Реакция вытеснения. CuSO4+Fe
PbI2+2KCH3COO 4) Реакция вытеснения. CuSO4+Fe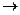 Cu+FeSO4 5) ОВР (4)
Cu+FeSO4 5) ОВР (4)
Вещество – одно из состояний материй. Материя – вещество и энергия. Вещества бывают простые и сложные.
Элемент – вид атомов с одинаковым зарядом ядра = порядковому номеру.
Аллотропия – существование вещества в нескольких формах.
Полиморфизм – существование сложных веществ в нескольких формах (оксид кремния – 13 модификаций)
Основные законы химии
- В изолированных системах сумма масс энергий постоянна.
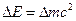 .
. - Закон постоянства вещества. Каждый химический элемент имеет определенный и постоянный состав, независимо от способа получения
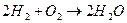 .
. - Закон эквивалента. Любые вещества вступают в реакции в отношениях, пропорциональных их эквивалентам.
Эквивалент – количество вещества, взаимодействующее с 1 молем атома водорода или замещающий его в химических реакциях. Масса эквивалента, выраженная в граммах, называется эквивалентной массой. [Э] [г/моль]. 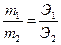 . В основаниях Э=М/2. В кислотах Э=М/3. В солях Э=М/6. В оксидах Э=М/10.
. В основаниях Э=М/2. В кислотах Э=М/3. В солях Э=М/6. В оксидах Э=М/10.
|
|
|
Моль – количество вещества, содержащее столько структурных единиц (атом, молекул, ион), сколько атомов в 12 г стабильного изотопа углерода C12.
- Закон Авогадро. При одинаковых физических условиях, в равных объемах газа содержится равное число молекул или атомов в случаях инертных газов (одноатомные газы).
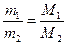 .
. 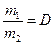 (плотность первого газа по второму).
(плотность первого газа по второму).
Номенклатура неорганических соединений.
H – гидрогениум, C – карбониум, О – оксигениум, N – нитрогениум, Ag – аргениум, Mn – манганум, Si – силигениум, S – сульфид, Fe – феррум, Cu – купрум, As – арсигениум, Sn – стану, Sb – стибию, Hg – гидраргиум.
Вещества классифицируют по свойствам: 1) Оксиды (солеобразующие (основные, кислотные, амфотерные) и несолеобразующие). 2) Гидроксиды (основания и кислоты) 3) Соли.
Кислоты классифицируют на: 1) 1-основная 2) 2-основная 3) 3-основная 4) 4-основная.
1) Бескислородные 2) Кислородсодержащие.
| Кислота | Анион | Соль | |||
| Формула | Название | Формула | Название | Формула | Название |
| HF | Второводородая | F1- | Вторидион | CaF2 | Вторид кальция |
| H2SO3 | Сернистая | Сульфит | |||
| H2S2O3 | Тиосерная | Тиосульфат | |||
| H2S2O7 | Пиросерная | Пиросульфат | |||
| H2S2O8 | Пероксодвусерная | Пероксодисульфат | |||
| H2Se | Селеноводородная | Селенид | |||
| H2SeO3 | Селенистая | Селенит | |||
| H2SeO4 | Селеновая | Селенат | |||
| H2SiO3 | Кремниевая | Силикат | |||
| HVO3 | Ванадиевая | Ванадат | |||
| H2S | Сероводородная | S2- | Сульфидион | CaOHF | Вторид гидросокальция |
| Ca(HS)2 | Гидросульфид кальция | ||||
| HCN | Циановодородная | CN1- | Цианидион | Fe(CN)3 | Цианид железа 3 |
| MCNS | Родановодородная | CNS1- | Роданид | Fe(CNS)3 | Роданид железа 3 |
| HClO4 | Хлорная | ClO41- | Пирохлорат | MgOHClO4 | Пирохлорат гидроксомагния |
| HClO3 | Хлорноватая | ClO3 | Хлорат | Fe(OH)2ClO3 | Хлоратдигидроксо железа 3 |
| HClO2 | Хлористая | ClO2 | Хлорид | CaClO2 | Хлорид кальция |
| HClO | Хлорноватистая | ClO | Гипохлорид | CaClO | Гипохлорид кальция |
| HMnO4 | Марганцовая | MnO41- | Перманганат | KMnO4 | Перманганат калия |
| H2MnO4 | Марганцовистая | MnO42- | Марганат | KHMnO4 | Гидроманганат калия |
| H2SO4 | Серная | SO4 | Сульфат | CaH(SO4)2 | Гидросульфат кальция |
| H2SO3 | Сернистая | SO3 | Сульфит | Fe(OH)2SO3 | Сульфат дигидроксожелеза |
| H2CrO4 | Хромовая | CrO4 | Хромат | Ba(OH)2CrO4 | Хромат дигидроксобария |
| H2Cr2O7 | 2-х хромовая | CrO7 | Бидихромат | (NH4)2Cr2O7 | Дихромат |
| HCrO2 | Метахромистая | Метахромит | |||
| HI | Иодоводород | Йодид | |||
| HOI | йодноватистая | Гипойодид | |||
| HIO3 | Йодноватая | Йодат | |||
| HIO4 | йодная | Перйрдат | |||
| H2WO4 | Вольфрамовая | WO4 | Вольфрамат | CaWHO4 | Гидровольфрамат кальция |
| HN3 | Азидоводород | ||||
| HNO3 | Азотная | NO3 | Нитрат | ||
| HNO2 | Азотистая | NO2 | Нитрит | ||
| H2P2O7 | Пирофосфорная | Дифосфат | |||
| H3PO4 | Ортофосфорная | PO43- | Ортофосфат | Ca3(PO4)2 | Ортофосфат |
| H3PO2 | Фосфорноватистая | Гипофосфит | |||
| HPO3 | Метафосфорная | PO31- | Метафосфит | Ca(PO3)2 | Метафосфад |
| H3PO3 | фосфористая | Фосфит | |||
| HPO2 | Метафосфористая | PO2 | Метафосфид | CaOHPO2 | Метафосфид гидроксокальция |
| KBeO2 | Бериллат калия | ||||
| Ca(HCO3)2 | Гидрокарбонат кальция | ||||
| HCN | Циановодородная | CN | Циано | Цианид | |
| NH4 | Аммоний | ||||
| HAlO3 | Метаалюминиевая | Метаалюминат | |||
| HAsO3 | Метамышьяковая | Метаарсенат | |||
| H3AsO4 | Ортомышьяковая | Ортоарсенат | |||
| HAsO2 | Метамышьяковистая | Метаарсенит | |||
| H3AsO3 | Ортомышьяковистая | Ортоарсенит | |||
| HBO2 | Метаборная | Метаборат | |||
| H3BO3 | Ортоборная | Ортоборат | |||
| H2B4O7 | Четырехборная | Тетраборат | |||
| H2C2O4 | Щавельная | Оксолат | |||
| HOBr | Бромноватистая | Гипобромат | |||
| HBrO3 | Бромноватая | Бромат | |||
| HCOOH | Муравьиная | Формиат | |||
| H2MoO4 | Молибденовая | Молибдат |
|
|
|
Строение атома.
|
|
|
Открытие в 1869 году Менделеевым термоядерного закона.
Открытие в 1879 катодных лучей Круксом.
В 1897 году Томсон назвал их электронами
1909 Милликем определил массу электронов и их заряд.
1886 Гольдштейн открыл гамма-лучи (полож. частицы).
1895 Открытие рентгеновских лучей
1896 Беккерель открыл радиоактивное излучение  .
.
1911 Резерфорд определил радиус ядра атома
1905 Томсон построил первую модель атома.
1911 Модель Резерфорда
1916 Модель Бора
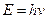
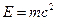
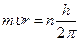
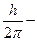 квант действия. n=1, 2, 3 – главное квантовое число.
квант действия. n=1, 2, 3 – главное квантовое число. 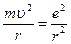 .
. 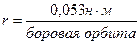 .
.
Движение электрона по эллиптической орбите является ускоренным.
e – Орбитальное квантовое число.
m – Магнитное квантовое число.
Квантово-Механическая модуляция основана на:
1) 1924 Луи де Бройль высказывает мысли, что электрон обладает волновыми свойствами.
2) 1927 Гейзенберг сформулировал принцип неопределенности
3) 1927 Шредингер. Дифракция электронов.
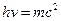
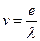
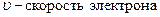
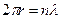
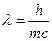 .
.
Принцип неопределенности: Произведение неопределенности положения и импульса не может быть меньше постоянной Планка. 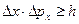 .
. 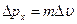 .
.
Нельзя одновременно определить с одинаковой точностью положение частицы и её импульс.
В квантовой механике нельзя говорить о точном положении частиц, а можно о вероятности нахождения электрона в данном элементе пространства.
Орбиталь – часть и форма пространства, вероятность нахождения в котором электрона равняется наперед заряженной величине, обычно 90 %.
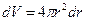 .
. 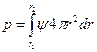
Квантовые числа. Их смысл и значение.
Цифра 1 2 3 4 5
Символ k l m n o.
Магнитное квантовое число характеризует распределение энергии электрона в пределах подуровня в зависимости от положения орбитали во внешнем магнитном поле.
Типовое квантовое число (ms) характеризует момент количества движения электрона при вращении вокруг своей оси.
1924 Принцип Паули. В атоме не может быть двух или более электронов, характеризующихся одинаковым набором значений четырех квантовых чисел.
Принцип Хунда: При возрастании заряда ядра атома электроны стремятся занять максимальное число орбиталей атомов, т.е. чтобы максимальная величина суммы значений типовых квантовых чисел была максимальна.
|
|
|
Принцип Ключевского.
1 правило. При возрастании заряда ядра, заполнение орбиталей происходит в порядке возрастания суммы n+l. l-орбитальное квантовое число. n – главное квантовое число.
2 правило. Если сумма значений n+l одинакова, то в первую очередь идет заполнение орбитали в порядке возрастания главного квантового числа.
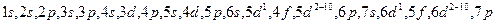 . Последняя буква указывает на принадлежность элемента к уровню.
. Последняя буква указывает на принадлежность элемента к уровню.
В связи с периодическим изменением электронных структур атомов, в связи с возрастанием заряда ядра периодически меняются: Атомные радиусы, потенциалы ионизации, сродство к электрону, электроотрицательность, валентность, степень окисления.
1) Радиус. Атомный радиус зависит не только от заряда ядра, но и от того, в какое соединение он входит. В связи с этим используется понятие эффективности атомного радиуса (половина расстояния между 2 атомами данного элемента в кристаллической решетке). Измеряется в нм и уменьшается в периоде 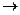 , в группах возрастает
, в группах возрастает 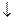 .
.
2) Потенциал ионизации: (Минимальное напряжение, которое необходимо свободному электрону для удаления его из 1 моля одиночных атомов). Э+J1=Э1++1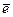 . J1-первый потенциал ионизации. [эВ]
. J1-первый потенциал ионизации. [эВ]
|
| Элемент | Li | Be | B | C | N | O | F |
| Заряд ядра | +3 | +4 | +5 | +6 | +7 | +8 | +9 |
| Потенциал ионизации | 5.4 | 9.3 | 8.3 | 11.3 | 14.5 | 13.6 | 17.4 |
3) Сродство к электрону. Это энергия, выделяемая при захвате одиночных электронов одним молем одиночных атомов.
Э+1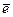 =Э1-
=Э1-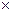 Е. Е-энергия сродства к
Е. Е-энергия сродства к 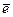 . E 0,6 0,4 0,3 1,3 -0,2 1,5 3.4 Растет слева направо.
. E 0,6 0,4 0,3 1,3 -0,2 1,5 3.4 Растет слева направо.
Li Be B C N O F
Поль. 1931. Характеристика электроотрицательности. Она бывает абсолютная Э1О=J+E и относительная ЭО-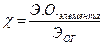 .
. 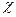 Li Be B C N O F Возрастает
Li Be B C N O F Возрастает 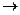 и
и 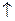 .
.
1 1.5 2 2.5 3 3.5 4
Типы связей: а) Неполярная 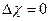 б) Полярная
б) Полярная 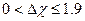 в) Ионная
в) Ионная 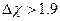
4) Провал 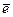 . Если у атома заполнение f или d подуровня близко к заполнению наполовину или полностью, то с выше лежащего уровня проваливается
. Если у атома заполнение f или d подуровня близко к заполнению наполовину или полностью, то с выше лежащего уровня проваливается 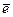 . Полученное состояние является энергетически выгодным (устойчивым). Cr, Cu, Ag, Me и f элементы. Например: 29Сu 1s22s22p63s23p64s23d9 (d-элемент). Провал – 3s23p64s13d10 или 3s23p64s13d94p1
. Полученное состояние является энергетически выгодным (устойчивым). Cr, Cu, Ag, Me и f элементы. Например: 29Сu 1s22s22p63s23p64s23d9 (d-элемент). Провал – 3s23p64s13d10 или 3s23p64s13d94p1
При возбуждении атомов элементов разрешен переход электронов только в пределах своего энергетического уровня (за исключением провалов 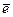 )
)
Химическая связь. Строение молекул.
Существует несколько типов химических связей, но природа едина и носит электросмешанный характер. При образовании связи энергия выделяется.
1) Ковалентная. а) Полярная. б) Неполярная
2) Ионная
3) Донорно-акцепторная
4) Водородная
5) Межмолекулярное взаимодействие
Для характеристики химических связей используется следующее понятие: энергия химической связи, длина, кратность, направленность, полярность.
Энергия связи определяется энергией, выделяющейся при возникновении химической связи. Если связей несколько (однотипных), то прочность 1 связи оценивается делением на число связи. Чем больше энергии выделяется, тем связь прочнее.
Длина связи. Половина расстояния между центрами ядер двусвязных атомов. Чем 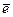 меньше, тем связь прочнее.
меньше, тем связь прочнее.
Кратность. Оценивается числом 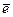 пар, связывающих 2 взаимодействующих атома. Чем кратность выше, тем длина меньше, а прочность выше. Этан: С-С; Этилен
пар, связывающих 2 взаимодействующих атома. Чем кратность выше, тем длина меньше, а прочность выше. Этан: С-С; Этилен  ; Ацетилен
; Ацетилен  .
.
Направленность. Это угол между воображаемыми линиями, проходящими через центры ядер 2 связанных атомов в молекуле.
Полярность. Оценивается смещением электронной пары к одному из ядер взаимодействующих атомов. Количественной характеристикой является дипольный момент
Диполь – электронная система, состоящая из 2 зарядов = по величине, но противоположных по знаку, находящихся на расстоянии. М=e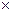 q –дипольный момент. q-эффективный заряд. e-длина диполя.
q –дипольный момент. q-эффективный заряд. e-длина диполя.
Ковалентная полярная связь. Возникает за счет неспаренных электронов различных атомов, либо за счет неподеленной пары 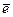 одного атома и свободной орбитали другого атома. Все возникшие при этом связи могут быть объяснены набором локализованных 2 центровых химических связей.
одного атома и свободной орбитали другого атома. Все возникшие при этом связи могут быть объяснены набором локализованных 2 центровых химических связей.
Межмолекулярные взаимодействия
Пусть А и В – вещества, где А – полярная молекула, а В – неполярная. Имеет три возможности их соединения, а именно:
а) А-А. Ориентационное взаимодействие между двумя полярными молекулами. l1>l0. 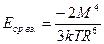 , где k-постоянная Больцмана, а М – дипольный момент.
, где k-постоянная Больцмана, а М – дипольный момент.
б) А-В. Возникает индукционное взаимодействие. Результатом является возникновение дипольного момента в неполярной молекуле. l1>l0. 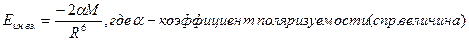 .
.
в) В-В. В неполярных молекулах могут возникать мгновенные диполи, вследствие пульсации электронного облака. Взаимодействие дисперсионное. 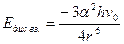 , где
, где 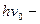 пулевая энергия, присущая каждой молекуле, при T=0
пулевая энергия, присущая каждой молекуле, при T=0 K (справочная величина)
K (справочная величина)
Несмотря на низкие энергии межмолекулярные взаимодействия на дисперсионном, например, основано сжижение газов.
Металлическая связь.
Металлы отличаются от других веществ 1) высокой электрической проводимостью и
2) теплопроводностью, а также они в обычных условиях являются кристаллическими веществами (за исключением ртути) с высокими координационными числами. Судя по первому свойству, очевидно, что часть электронов может перемещаться по всему объему куска металла. С другой стороны из кристаллической структуры металлов следует, что их атомы не связаны друг с другом локализованными двухэлектронными связями, ибо числа валентных электронов атома недостаточно для образования подобных связей со всеми его соседями.
Рассмотрим металлическую связь на примере лития. Каждый его атом имеет по восемь ближайших соседей. Для образования двухэлектронных связей в подобной структуре, атом лития должен предоставить восемь электронов, но это невозможно, так как его валентность всего 1. В кристалле лития орбитали соседних атомов перекрываются. Каждый атом предоставляет на связь четыре валентные орбитали и один валентный электрон. Значит, в кристалле металла число электронов меньше числа орбиталей. Поэтому электроны могут переходить из одной орбитали в другую. Электроны принимают участие в образовании связи между всеми атомами кристалла металла. К тому же атомы металлов характеризуются невысокой энергией ионизации – валентные электроны слабо удерживаются в атоме, т.е. легко перемещаются по всему кристаллу.
Таким образом, в отличие от ковалентных и ионных соединений в металлах небольшое число электронов одновременно связывают большое число атомных ядер, а сами электроны могут перемещаться в металле. Иначе говоря, в металлах имеет место сильно делокализованная химическая связь.
Элементы химической термодинамики.
Занимается изучением макросистем.
Термодинамическая система – совокупность взаимодействующих веществ, имеющих видимые или воображаемые границы с окружающей средой.
Они бывают: Изолированные и неизолированные.
Изолированные не обмениваются с внешней средой ни массой, ни энергией. Неизолированные делят на: открытые и замкнутые.
Открытые обмениваются и массой и энергией, а замкнутые только энергией.
Они бывают: Гомогенные, гетерогенные.
Гомогенные системы – системы, в которых состав и свойства не меняются в пространстве и во времени.
Гетерогенные системы – обычно однофазные. Состоят из нескольких фаз, свойства которых на границе раздела меняются скачком (дискретно)
Фаза – совокупность гомогенных частей системы, отличающихся по составу и свойствам или только по свойствам. Состав однороден или непрерывно меняется от точки к точке.
Параметр – свойство системы, которое можно измерить. Изменение параметров – процесс.
Параметры бывают: Экстенсивные и интенсивные.
Экстенсивные – Т, молярная масса, теплоемкость – не зависят от количества вещества
Интенсивные – объем, масса.
Уравнение состояния системы – связь между параметрами.
Процессы бывают: Самопроизвольные, вынужденные.
Самопроизвольные – протекающие в одном направлении, в результате которых не наступают существенные изменения в окружающей среде и системе.
Вынужденные – протекают при существующем внешнем воздействии, в результате которых наступают изменения в системе и окружающей среде.
Процессы бывают: Равновесные (в прямом и обратном направлении), неравновесные (только в прямом)
Химическая термодинамика позволяет: 1) Оценить тепловые эффекты процессов 2) возможность и направление процессов 3) научиться управлять процессами и рассчитывать, до каких равновесных состояний процесс протекает 4) выход продукта реакции.
Химическая термодинамика базируется на 2 законах:
1 ЗАКОН: Энергия не возникает и не исчезает, а превращается в другую, в эквивалентных количествах. 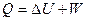 . U – Энергия взаимодействия всех частиц системы, куда не входит Ек и Еп. W – затраченная и полезная работа. Полезная, если меняется состав системы.
. U – Энергия взаимодействия всех частиц системы, куда не входит Ек и Еп. W – затраченная и полезная работа. Полезная, если меняется состав системы.
Изобарный процесс.
 .
. 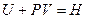 - энтальпия (полное теплосодержание системы (внутренняя энергия и потенциальная работа)).
- энтальпия (полное теплосодержание системы (внутренняя энергия и потенциальная работа)).
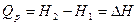
Изохорный процесс.
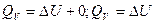 . Если не учитывать в реакции газо- и парообразные вещества, то
. Если не учитывать в реакции газо- и парообразные вещества, то 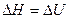
Основным законом термодинамики является закон Гесса Г.Н.: Тепловой эффект химической реакции не зависит от пути процесса, а определяется видом и состоянием конечных и исходных веществ. Он справедлив при T=const.
Следствие: Тепловой эффект реакции равен сумме энтальпий образований конечных веществ минус сумма энтальпий начальных.
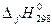 -стандартное Н образования, где 0-давление, f-образование, 298 – стандартная температура.
-стандартное Н образования, где 0-давление, f-образование, 298 – стандартная температура.
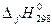 - это тепловой эффект реакции образования сложных веществ из устойчивых модификаций простых веществ, следовательно, для простых веществ
- это тепловой эффект реакции образования сложных веществ из устойчивых модификаций простых веществ, следовательно, для простых веществ 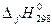 =0, а для сложных – справочная величина [кДж/моль]
=0, а для сложных – справочная величина [кДж/моль]
Эндотермический процесс 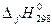 >0
>0
Экзотермический процесс 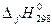 <0
<0
Знание теплового эффекта реакции не позволяет определить направленность, хотя большинство самопроизвольных процессов – экзо.
2 Закон термодинамики. Единственным результатом любой совокупности процессов не может быть только лишь переход энергии от менее нагретого тела к более нагретому (Клаузиус 1850 год)
Энтропия (превращение энергии) – логарифмическая термодинамическая вероятность. 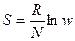 [Дж/моль К].
[Дж/моль К].
Термодинамическая вероятность – совокупность микросостояний, посредством которой может быть реализовано данное макросостояние. 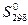 - стандартная энтропия. Абсолютную величину можно измерить. Если
- стандартная энтропия. Абсолютную величину можно измерить. Если 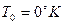 то
то 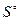 =0 – функция неупорядоченности системы. S – мера бесполезности теплоты. Используется для определения направления процесса в изолированных системах. Процесс протекает самопроизвольно, если
=0 – функция неупорядоченности системы. S – мера бесполезности теплоты. Используется для определения направления процесса в изолированных системах. Процесс протекает самопроизвольно, если 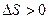 . При достижении равновесного состояния
. При достижении равновесного состояния 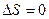 , а само S достигает максимального значения (изолированная система). Для определения направления процесса неизвестной системы используют энергию Гиббса.
, а само S достигает максимального значения (изолированная система). Для определения направления процесса неизвестной системы используют энергию Гиббса.
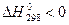 при стандартных условиях. В самопроизвольных процессах
при стандартных условиях. В самопроизвольных процессах  .
.
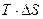 (энтропийный фактор)
(энтропийный фактор)
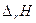 (энтальпийный фактор)
(энтальпийный фактор)
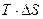 >
>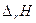 обычно
обычно
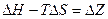 (изобарно-изотермический потенциал – назвал Гиббс)
(изобарно-изотермический потенциал – назвал Гиббс)
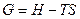 - энергия Гиббса. Абсолютную величину нельзя измерить.
- энергия Гиббса. Абсолютную величину нельзя измерить.
 - можно измерить. Является также мерой химического сродства – способность взаимодействовать друг с другом.
- можно измерить. Является также мерой химического сродства – способность взаимодействовать друг с другом.
1) Если 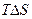 >
>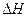 , то
, то 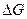 <0. Вещества обладают химическим сродством. Протекают в прямом направлении.
<0. Вещества обладают химическим сродством. Протекают в прямом направлении.
2) Если 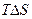 <
<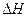 , то
, то 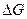 >0. Реакция самопроизвольно протекает в обратном направлении.
>0. Реакция самопроизвольно протекает в обратном направлении.
3) Если 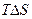 =
=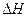 , то
, то 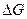 =0. Система в состоянии равновесия. Протекает в прямом и обратном направлениях с постоянной скоростью.
=0. Система в состоянии равновесия. Протекает в прямом и обратном направлениях с постоянной скоростью.
4) 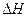 <0,
<0, 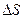 >0 – при любых
>0 – при любых 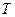 , то
, то 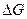 <0.
<0.
5) 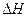 >0,
>0, 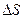 <0 -
<0 - 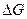 >0. Процесс невозможен в прямом направлении.
>0. Процесс невозможен в прямом направлении.
6) 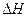 >0,
>0, 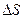 >0 – при достижении некоторой T
>0 – при достижении некоторой T 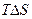 >
>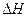 - процесс возможен
- процесс возможен
7) 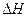 <0,
<0, 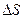 <0 – при достижении некоторой T, процесс невозможен.
<0 – при достижении некоторой T, процесс невозможен.
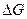 связано с const химического равновесия. Рассмотри реакция превращения А в В.
связано с const химического равновесия. Рассмотри реакция превращения А в В.
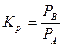 .
. 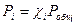 .
. 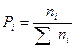 , где Рi-парциальное давление.
, где Рi-парциальное давление.
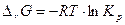 . Если
. Если 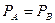 , то
, то 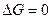 .
.
В химической реакции 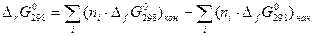 . Для простых веществ
. Для простых веществ 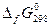 =0.
=0. 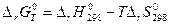
Химическая кинетика и химическое равновесие.
Химическая кинетика – учение о скорости и механизме протекания реакций.
Скорость реакции – изменение действующей массы (Д.М.) в единицу времени в единице объема для гомогенных и на единице поверхности для гетерогенных.
В качестве Д.М. можно использовать любую характеристику, связанную с количеством взаимодействующих веществ.
Механизм – последовательность протекания отдельных стадий. Если одна из стадий протекает с меньшей скоростью, то эта стадия называется лимитирующей.
На скорость реакции влияют: концентрация, температура, катализаторы. Предположим, что мы рассматриваем гомогенные, односторонние. Д.М. – молярная концентрация – С.
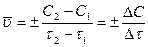 .
. 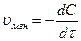 =
=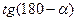 .
.
Основным законом химической кинематики является закон Д.М. (ЗДМ), сформулированный в 1865-1867 годах Гульберном и Вааге: При постоянной температуре скорость химической реакций прямо пропорциональна произведению действующих масс реагирующих веществ.
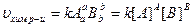 , где А и В – концентрации. k – const химической реакции. Если
, где А и В – концентрации. k – const химической реакции. Если 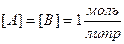 , то
, то  .
.
Физический смысл константы скорости реакции: k – равняется скорости реакции при единичных концентрациях веществ. Зависит от природы реагирующих веществ и Т.
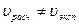 . Это связано с тем, что реакция сложная, протекает в несколько стадий, а записанное уравнение отражает только результат, а не отдельную стадию.
. Это связано с тем, что реакция сложная, протекает в несколько стадий, а записанное уравнение отражает только результат, а не отдельную стадию.
Обычно химические реакции классифицируют по молекулярности и порядку.
Под молекулярностю понимают число молекул, участвующих в элементарных химических взаимодействиях. Знание молекулярности еще недостаточно для записи уравнения ЗДМ.
Порядок реакции n. Различают 0-порядковые и более.
Порядок реакции – число молекул, участвующих в определяющей стадии.
Введение n позволяет выполнять расчеты, но не вскрывает механизм реакции.
Закономерности реакций последних порядков.
1 Порядок
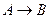 . (1 порядок) С – концентрация, тогда
. (1 порядок) С – концентрация, тогда 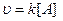 , [A]=C
, [A]=C 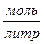 . Имеем
. Имеем 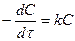
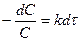 ,
, 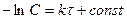 .
.
Если 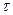 =0, то С=С0, тогда
=0, то С=С0, тогда 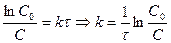 .
.
Пусть а – исходное число моль, а x – число моль в момент 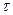 , тогда a-x – число моль вещества, вступивших в реакцию.
, тогда a-x – число моль вещества, вступивших в реакцию. 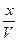 - текущая концентрация.
- текущая концентрация. 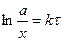 .
. 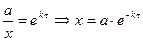 .
.
Для сравнения скорости реакций вводится период полупревращения (время, за которое концентрация реагирующего вещества уменьшается на 50%)
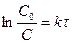 .
.
Если 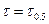 , то
, то 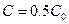
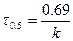 . Период полупревращения 1-го порядка не зависит от концентрации.
. Период полупревращения 1-го порядка не зависит от концентрации.
2 Порядок
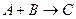 ,
, 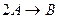 .
. 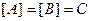
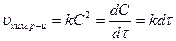
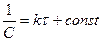 .
.
Если 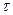 =0, то С=С0.
=0, то С=С0. 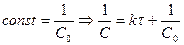 ,
, 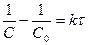 ,
, 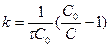 .
.
Если 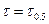 , а С=0.5С0, то
, а С=0.5С0, то 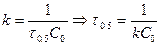 . Период полупревращения зависит от С.
. Период полупревращения зависит от С.
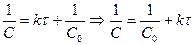 .
. 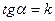 .
.
Реакции 3 порядка.
Порядок реакции это сумма показателей степеней, при которых концентрации входят в ЗДМ.
A+B+D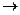 E. 3A
E. 3A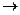 B.
B.
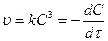 .
.
Если 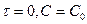 , то
, то 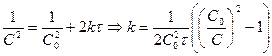 .
.
Если 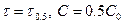 , то
, то 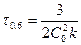 . Зависит от С.
. Зависит от С.
Реакции n-ого порядка
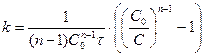 .
.
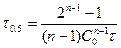 .
.
Реакции 0-го порядка – это реакции, в которых скорость хим. реакции не зависит от С.
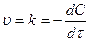 .
.
При 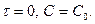
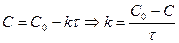
При 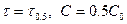
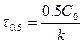 - зависит от С.
- зависит от С.
Закономерности протекания сложных реакций
Сложные – порядок не совпадает с числом молекул веществ, участвующих в суммарном уравнении реакций. Закономерности таких реакций определяются правилом независимого протекания Вильгельма: При одновременном протекании нескольких реакций, каждая из них протекает независимо и подчиняется закону действующих масс.
1) Последовательные реакции. Если 
2) Параллельные 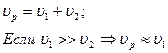
3) Двусторонние (обратные) 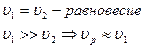
Способы определения порядка реакции
1) По постоянству k. 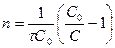
2) Способ расчета n при равенстве С исходных веществ:
а) Графический метод (выбирается система координат, дающая прямолинейную зависимость С во время 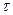
б) Аналитический метод. Определяется n по 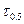 .
. 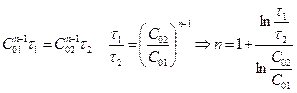
Для определения n, задаются 2 различными исходными С.
3) По скорости химической реакции (метод Вантгоффа)
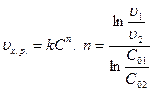 . При определении скорости хим. реакции обычно используют средние концентрации и средние скорости.
. При определении скорости хим. реакции обычно используют средние концентрации и средние скорости.
Если в результате расчета не получаются целые порядки, то обычно принимают ближайшее целое число.
4) Метод понижения порядка реакции. Для определения порядка сложной реакции обычно определяется порядок реакции по каждому из реагирующих веществ, для чего задаются избытком все остальные вещества. 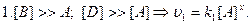
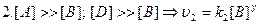 .
. 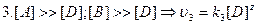 .
.
n=x+y+z
Влияние Т на скорость химической реакции.
Зависимость 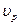 от Т проявляется через k. (Сванге-Арениус).
от Т проявляется через k. (Сванге-Арениус). 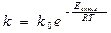 .
.
Еакт – минимальная Е, по сравнению со средней энергией теплового движения молекул, необходимую для начала химической реакции 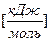 .
. 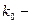 предэкспоненциальный множитель, зависящий от природы реагирующих веществ, способа соударения молекул и частоты соударений.
предэкспоненциальный множитель, зависящий от природы реагирующих веществ, способа соударения молекул и частоты соударений.
Еакт определяется 2 способами: 1) аналитически 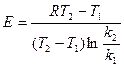 ; 2) графически.
; 2) графически.
Если Еакт зависит от Т, то данная реакция сложная и Еакт кажущаяся. Также это указывает на то, что реакция сложная и рассмотренный механизм не является истинным. В растворах Еакт 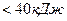 . Для реакций между веществами с ковалентными химическими связями Еакт>120 кДж. Для реакций, протекающий со скоростью Еакт,
. Для реакций между веществами с ковалентными химическими связями Еакт>120 кДж. Для реакций, протекающий со скоростью Еакт, 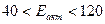 кДж.
кДж.
Правило Вант-Гоффа: 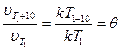 (температурный коэффициент)
(температурный коэффициент)
При нагревании системы число активных молекул растет примерно в 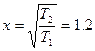 раза.
раза.
Влияние катализаторов на скорость химической реакции.
Катализ – изменение 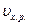 в присутствии катализатора.
в присутствии катализатора.
Катализатор – вещество, участвующее в промежуточных взаимодействиях и восстанавливающее свой первоначальный вид в конце реакции. Катализаторы делят по агрегатному состоянию на:
а) Гомогенные (катализатор и взаимодействующие вещества находятся в одной фазе);
б) Гетерогенные (катализатор и взаимодействующие вещества находятся в разных фазах).
Для улучшения свойств катализатора используют специальные добавки – промоторы.
Если катализатор ускоряет процесс, то катализ положительный.
В некоторых химических процессах катализатором могут быть продукты реакции, в таком случае процесс называют автокаталитическим.
Важное свойство катализаторов – селективность (способность из нескольких возможных реакций ускорять нужную)
Еще не вскрыт механизм некоторых катализаторов. Существует несколько теорий гетерогенного катализа: 1) теория мультиплетная Баландина; 2) Теория активных ансамблей; 3) Теория полупроводниковая Волькенштейна.
Все теории едины в одном: 1) В присутствии катализаторов реакции протекают по другому пути, требующему меньшей Еакт. 2) В присутствии катализаторов образуются промежуточные вещества, соединяющиеся с катализатором, которые в результате рекомбинации атомов или взаимодействии с другими веществами образуют продукты реакции, а катализаторы восстанавливают свой первоначальный вид.
Химическое равновесие и закон действующих масс.
Если в результате химической реакции расходуется полностью хотя бы одно из реагирующих веществ, то реакция необратимая.
Наступление равновесия свидетельствует о том, что процесс протекает с одинаковой скоростью в обоих направлениях (динамическое равновесие).
Закон Д.М. для состояния равновесия: Отношение произведения Д.М. продуктов реакции к произведению Д.М. исходных веществ с учетом стехиохимических коэффициентов есть величина постоянная при данной Т и называется константой равновесия.
В случае гетерогенных реакций, в уравнение закона Д.М. входят только вещества, находящиеся в газо - или парообразном состоянии.
Растворы
Если привести в соприкосновение 2 или более веществ, то возможны следующие варианты процессов: 1) Химические; 2) Физические; 3) Физико-химические.
Образование растворов – физико-химический процесс. Растворы бывают: газовые, жидкие, твердые (по агрегатному состоянию).
В растворах различают растворитель и растворяемое вещество. Если вещества находятся в разных агрегатных состояниях, то растворитель – вещество, находящееся в одной фазе с полученным раствором. Если вещества находятся в одинаковых агрегатных состояниях, то растворитель то вещество, которого больше.
Электролиты – растворяемые вещества.
Характеристика растворов – концентрация. а) Разбавленный; б) Концентрированный (содержание р-ля и растворяемого в-ва сопоставимо).
Способы выражения концентрации растворов.
Концентрация – содержание растворяемого вещества, выраженное в единицах массы или количества, приходящиеся на единице массы или объема раствора или растворителя.
1) Массовая доля. 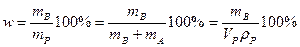 - количество единиц массы растворенного вещества, содержащиеся в 100 единицах массы раствора.
- количество единиц массы растворенного вещества, содержащиеся в 100 единицах массы раствора.
2) Молярная концентрация. 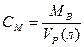 [Моль/литр] – количество моль растворенного вещества, содержащиеся в 1л раствора. 0.1М –децимолярный раствор, 0.2М – двухдецимолярный раствора, 0.01 – сантимолярный раствор, 0.001 – миллимолярный раствор.
[Моль/литр] – количество моль растворенного вещества, содержащиеся в 1л раствора. 0.1М –децимолярный раствор, 0.2М – двухдецимолярный раствора, 0.01 – сантимолярный раствор, 0.001 – миллимолярный раствор.
3) Нормальная концентрация или нормальность. 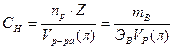 [моль экв/литр] Нормальность – количество моль эквивалентов растворенного вещества, содержащиеся в 1л раствора.
[моль экв/литр] Нормальность – количество моль эквивалентов растворенного вещества, содержащиеся в 1л раствора.
4) Молярная концентрация, молярность. 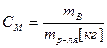 .
. 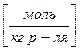 Молярность – количество моль раствора вещества, содержащееся в 1 кг растворителя.
Молярность – количество моль раствора вещества, содержащееся в 1 кг растворителя.
5) Массовая доля. 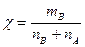 .
. 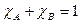 . Молярная доля – отношение количества моль растворенного вещества к сумме моль всех веществ, составляющих раствор.
. Молярная доля – отношение количества моль растворенного вещества к сумме моль всех веществ, составляющих раствор. 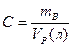 [г/л]
[г/л]
Использование нормальных С позволяет рассчитывать V растворов, которые, будучи смешанными, провзаимодействуют без остатка.
Растворимость
Растворимость 1 в 2 обусловлено процессом диффузии, т.е. распределением молекул растворенного вещества в среде молекул растворителя. При этом энтропия системы растет, а энергия Гиббса уменьшается.
При достижении состояния равновесия 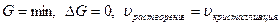 .
.
Растворимость (S) – С насыщенного раствора. 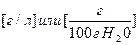 .
.
Перенасыщенные растворы – растворы, в которых содержание растворенного вещества больше насыщенного растворителя. Они неустойчивые (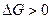 )
)
Вещества хорошо растворимы, если С>1г/100г H2O.
Мало растворимы, если 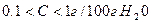
Нерастворимы, если 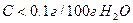 .
.
Физико-химическая теория образования раствора (Сванге-Арениус).
Физико-химическая теория свидетельствует о том, что образование раствора – химический процесс. Подтверждение – очень часто компоненты нельзя разделить на составные части.
Процесс растворения сопровождается тепловым эффектом, поэтому Менделеев создал физико-химическую теорию образования растворов, согласно которой все процессы образования раствора находятся в состоянии термодинамического равновесия и подчиняются закону Д.М.
При растворении образуются вещества переменного состава – сольваты и гидраты.
Типы взаимодействия: 1) Дальнего порядка (межмолекулярные взаимодействия, ион-дипольные, диполь-дипольные, проявляющиеся на дальних расстояниях). 2) Специфическое взаимодействие (проявляется на близких расстояниях. Это взаимодействие обусловлено возникновением водородных и донорно-акцепторных химических связей, что связано с перестройкой электронных оболочек атома).
Объемные и энергетические эффекты образования растворов.
При растворении, частицы растворенного вещества распределяются между растворителем и объемом системы. 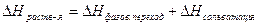 (Если H2O, то гидротация).
(Если H2O, то гидротация). 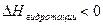 .
. 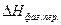 >0 в эндотермических, и <0 при экзотермических.
>0 в эндотермических, и <0 при экзотермических.
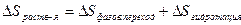 .
. 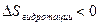 ,
, 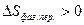 ,
, 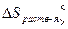 0 для твердых веществ.
0 для твердых веществ.
При растворении газов 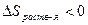 ,
, 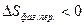 ,
, 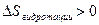 .
.
Идеальные растворы - э то растворы неэлектролитов и их очень разбавленные растворы.
Важные характеристики растворов: С, Рн.п., Ткрист-ии, осмотическое давление. Рн.п – пар, находящийся в равновесии с его жидкой фазой, когда 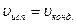
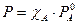 - 1 уравнение 1 закона Рауля.
- 1 уравнение 1 закона Рауля.
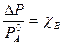 - 2 уравнение 1 закона Рауля.
- 2 уравнение 1 закона Рауля.
Относительное понижение давления насыщенного пара в растворителе для растворов 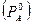 равно молярной доле растворенного вещества.
равно молярной доле растворенного вещества.
Изменение Ткип в растворах.
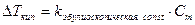 .
.
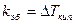 , когда
, когда 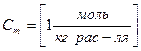 . Для воды
. Для воды 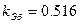
 .
.
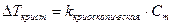
Для воды 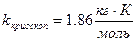
Изменение 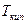 и
и 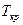 зависит от числа частиц растворенного вещества и не зависит от природы растворителя.
зависит от числа частиц растворенного вещества и не зависит от природы растворителя.
Осмотическое давление.
Осмос – явление проникновения растворителя в раствор через полунепроницаемую перегородку.
Осмотическое давление – это давление, которое нужно оказать на раствор, чтобы осмос прекратился. Явление осмоса вызвано односторонней диффузией. 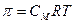 .
.
Растворы электролитов.
Для электролитов 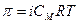 .
. 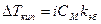 .
. 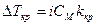 .
.
1862 год Сванге-Арениус: электролитическая диссоциация – процесс распада частиц молекул электролита на ионы под действием молекул растворителя.
Степень диссоциации 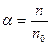 , где n – число растворившихся молекул, а n0 – исходное число молекул.
, где n – число растворившихся молекул, а n0 – исходное число молекул.
Степень диссоциации электролита зависит от: 1) от природы растворителя (проявляется через диэлектрическую проницаемость 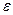 ); 2) от природы растворенного вещества и концентрации при данной T.
); 2) от природы растворенного вещества и концентрации при данной T.
По степени диссоциации электролиты делят на сильные, слабые, средней силы.
1) Сильные: 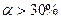 . Неорганические к-ты (HCl, HBr, HI, H2SO4,HClO4,HMnO4), основания щелочных и щелочноземельных металлов (Ca, Sn, Ba) и почти все соли.
. Неорганические к-ты (HCl, HBr, HI, H2SO4,HClO4,HMnO4), основания щелочных и щелочноземельных металлов (Ca, Sn, Ba) и почти все соли.
2) Слабые: 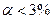 . Неорганические кислоты (HSO3, HF, HCN, HCNS, H2S, H2Se, H3PO3), органические кислоты, основания (NH4OH, AlO3, PO3,d-элементы), соли (Fe(CNS)3, Hg2Cl2)
. Неорганические кислоты (HSO3, HF, HCN, HCNS, H2S, H2Se, H3PO3), органические кислоты, основания (NH4OH, AlO3, PO3,d-элементы), соли (Fe(CNS)3, Hg2Cl2)
3) Средние: 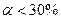 . Неорганические кислоты (H2CrO4, MnO4, HCOOH, H3PO4, H2SO3), основания (Mn(OH)2).
. Неорганические кислоты (H2CrO4, MnO4, HCOOH, H3PO4, H2SO3), основания (Mn(OH)2).
С разбавлением раствора 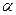 увеличивается.
увеличивается.
Слабые электролиты
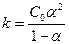 - разведение Оствальда, где С0 – число образовавшихся ионов.
- разведение Оствальда, где С0 – число образовавшихся ионов.
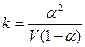 .
.
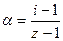 . (Z – число частиц, образующихся из 1 молекулы).
. (Z – число частиц, образующихся из 1 молекулы).
Чем меньше 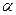 , тем слабее электролит.
, тем слабее электролит.
Слабые многоосновные кислоты и многоосновные основания в водных растворах диссоциируют ступенчато.
Слабые электролиты.
В виду высокой концентрации ионов в растворах сильных электролитов образуются частицы (ассоциаты или ионные пары).
В ионных парах ионы разделены одним или более слоями.
Для растворов электролитов в качестве Д.М. применяется активность (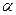 - термоядерная характеристика (эффективная концентрация, в соответствии с которой, ионы проявляют себя в действии))
- термоядерная характеристика (эффективная концентрация, в соответствии с которой, ионы проявляют себя в действии))
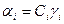 , где
, где 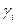 - коэффициент активности. Этот коэффициент характеризует отклонение поведения реального раствора от идеального. Для учета действия всех ионов на активность каждого из них Льюис и Рендел в 1918 году ввели характеристику – ионная сила раствора.
- коэффициент активности. Этот коэффициент характеризует отклонение поведения реального раствора от идеального. Для учета действия всех ионов на активность каждого из них Льюис и Рендел в 1918 году ввели характеристику – ионная сила раствора.
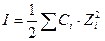 , где
, где 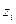 - заряд i-ого иона.
- заряд i-ого иона.
Ввиду того, что нельзя экспериментально определить коэффициент активности отдельного иона, используют средний коэффициент активности. 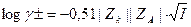 - уравнение Де-Бойля и Хюпкеля.
- уравнение Де-Бойля и Хюпкеля.
Для растворов сильных электролитов в уравнение З.Д.М. включают не аналитические концентрации, а соответствующие активности ионов.
Индикаторы
Индикаторы – это вещества, изменяющие свою окраску в зависимости от характера среды. В качестве индикаторов применяют слабые кислоты или слабые основания.
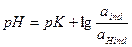 .
.
Индикаторы бывают: 1-цветные, 2-х цветные, 3-х цветные.
Произведение растворимости.
Абсолютно нерастворимого вещества не существует.
Произведение растворимости = ПР
ПР=ПР концентраций ионов труднорастворимого электролита в степенях, равных их числу в молекуле (справочная величина)
CaF2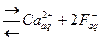 .
. 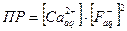 .
.
На растворимость влияет Т, природа растворителя, присутствие посторонних электронов.
Равновесие в растворах комплексных солей.
Комплексные соли в водных растворах диссоциируют на ионы внешней и внутренних сфер по типу сильных электролитов.
Ионы внутренней сферы диссоциируют по типу слабых электролитов ступенчато.
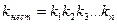 . kнест – константа нестойкости.
. kнест – константа нестойкости.
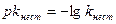
Обменные реакции в растворах электролитов
Это реакции, протекающие без изменения зарядов ионов в них участвующих. Обменные реакции протекают слева направо, если в результате образуется малорастворимое, малодиссационное газообразное вещество или КС.
Малорастворимые, малодисационные, газообразные вещества записывают в виде молекул, в независимости от части уравнения. Сильные, хорошо растворимые электролиты записывают в виде ионов, несмотря на часть уравнения.
Гидролиз
Гидролиз – обменные разложения веществ воды.
Гидролизу могут подвергаться соли, образованные:
1. Сильным основанием и слабой кислотой: Na2CO3, K2CO3, KNO2;
2. Сильной кислотой и слабым основанием: NH4Cl, CuSO4, NiCl2;
3. Слабая кислота и слабое основание: NH4CN, (NH4)2CO3, Al(CH3COO)3 (ацетат Al)
Гидролиз солей, образованных слабыми многоосновными кислотами и многоосновными основаниями, протекают ступенчато.
При гидролизе солей слабых оснований наблюдается образование донорно-акцепторных связей за счет свободных орбиталей катионов и неподеленной электронной пары анионов кислорода молекул воды.
Гидролиз тем сильнее, чем выше заряд катиона и ниже его радиус.
Гидролиз анионов происходит за счет возникновения водородных химических связей, посредством атомов H молекул воды и анионов.
Взаимно-усиливающий гидролиз
Гидролиз солей трехвалентных металлов (Al, Cl, Fe) в присутствии CO3, сульфидов и сульфитов щелочных металлов и сульфида аммония протекает до конца.
Гидролиз солей двухвалентных металлов (Zn, Cu, Cd, ртуть, Fe, Cr, Mn, Co, Pb, Cu) в присутствии CO3 щелочных металлов, заканчивается на первой ступени с образованием CO3 гидроксометалла (II), выделением CO2, и образованием соли щелочного металла.
Процесс гидролиза зависит от концентрации соли, природы электролита и температуры:
1) Концентрация. С уменьшением концентрации степень гидролиза возрастает, т.к. увеличивается число молекул воды, приходящихся на 1 гидрализующийся ион.
2) Природа электролита. Чем слабее электролит, образующий данную соль, тем выше степень гидролиза.
3) Температура. Процесс гидролиза – эндотермический. В соответствии с принципом Ле-Шателье с возрастанием температуры выход продукта эндотермических реакций возрастает.
Окислительно-восстановительные реакции.
ОВР – реакции, протекающие с изменением степеней окисления атомов элементов веществ, участвующих в реакции.
Вещества, атомы элементов которых отдают электроны, называются восстановителем.
Вещества, атомы элементов которых принимают электроны – окислители.
3 Типа ОВР:
1) Межмолекулярные реакции; 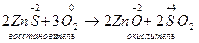
2) Внутримолекулярные реакции; 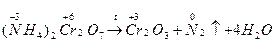
3) Реакции самовосстановления и самоокисления. 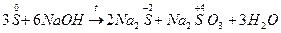 ;
;
Способ уравнивания ОВР – метод полуреакций, метод ионно-электронного баланса.
Метод ионно-электронного баланса.
1) Знать исходные и конечные вещества;
2) Расставить степени окисления атомов элементов веществ;
3) Исходя из степени окисления, найти окислитель и восстановитель;
4) Написать схемы электронного баланса. Исходя из равенства отданных и принятых элементов, определить коэффициенты уравнения;
5) Расставить коэффициенты перед оставшимися веществами;
6) Проверить правильность коэффициентов по одному из элементов.
Метод полуреакций.
Связывание кислорода окислителем в кислой определяется за счет протонов с образованием молекул воды, а в щелочной и нейтральной среде за счет гидроксидов с образованием молекул воды.
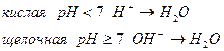
Присоединение кислорода восстановителем в кислой и нейтральной среде осуществляется за счет молекул воды с образованием протонов, а в щелочной среде за счет гидроксид ионов с получением молекул воды.
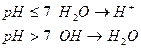
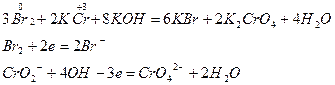

Метод ионно-электронного баланса применим к реакциям в водных растворах.
Метод электронного баланса – универсален.
Важнейшие окислители.
1) Простые вещества, находящиеся в периодической системе в 7 группе главной подгруппы – галогены: кислород, азот, сера, фосфор и др.
2) Г2+2e=2Г- 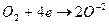
3) Ионоводороды в растворах разбавленных кислот при взаимодействии с активными металлами. 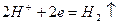
4) Ионы металлов в высшей степени окисления 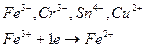
5) 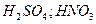 и её соли, кислород содержащие кислоты, марганаты, хроматы,
и её соли, кислород содержащие кислоты, марганаты, хроматы, 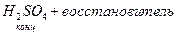 1) активные металлы: Zn, Mg, Ca …
1) активные металлы: Zn, Mg, Ca …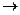
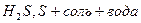
2) неактивные металлы 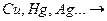
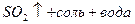
3) Al, Fe, Cr – пассивация
4) неметаллы 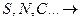
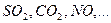
Азотсодержащая кислота: При взаимодействии А.К. с любым восстановителем никогда не выделяется кислород.!!!
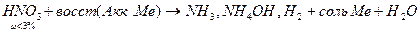
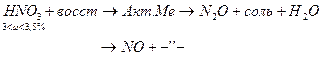

Результаты ОВР часто зависят от характера среды, рассмотрим на примере перманганатов (KMnO4)
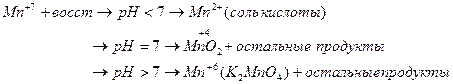
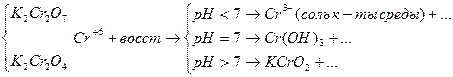
Если окислителем выступает кислородсодержащие кислоты и соль Cr и Br, то восстановление галогенов идет до степени окисления -1. 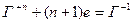
В случае кислородсодержащих кислот йода и их солей, восстановление идет до 0-ой степени
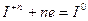
Некоторые вещества, атомы которых находятся в промежуточной степени окисленности: 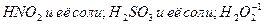 и другие вещества, могут проявлять окислительно-восстановительную двойственность:
и другие вещества, могут проявлять окислительно-восстановительную двойственность:
В присутствии сильных окислителей проявляются свойства восстановителей и наоборот.
Пример двойственности:
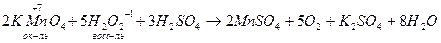
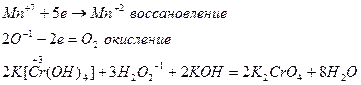
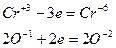
Уравнение Аррениуса (точное): k = A·exp(-Ea / RT). Уравнение Вант-Гоффа (грубое): v2 / v1 = (T2-T1) / 10. Экспериментальное определение Ea: по тангенсу угла наклона прямой на графике ln(K) от 1/T: Ea = R * tg(). Скорость параллельной реакции определяется скоростью самой быстрой реакции. Скорость последовательной реакции определяется скоростью самой медленной реакции. Катализ — процесс изменения скорости химической реакции. Не изменяет константу равновесия. DG = const. Катализатор — ускоряющее реакцию вещество, не участвующее в превращениях. Действие катализатора основано на уменьшении энергии активации при образовании активированного комплекса. Гомогенный катализ: катализатор и реагенты находятся в одной фазе. Гетерогенный катализ: катализатор и реагенты находятся в разных фазах; реакция протекает на границе раздела фаз.
Растворы
Раствор — гомогенная (однофазная) система переменного состава двух и более компонентов. XY D (поляризация) D XYD (ионизация) D XYD (сольватация) D X/YD (дисс) D X+YAX (растворённое) + nS D (AX)Sn D A+Sn+ + X-Sn- — процесс сольватации. Способы выражения концентрации. Молярная концентрация [моль/л (М)]: вещества в растворе к объёму раствора. Моляльность [моль/кг]: вещества в растворе к массе растворителя. Молярная доля [%]: количество компонента в растворе к общему количеству компонентов. Массовая доля [%]: масса компонента к массе раствора (сколько граммов на 100 г раствора). Классификация. По числу компонентов: Бинарные (2 компонента) и многокомпонентные. Растворитель — тот, что в избытке. По агрегатному состоянию: Жидкие (водные и неводные) Твёрдые (растворы внедрения и замерзания) Газообразные (равновесные смеси газов в любых соотношениях)
По концентрации: Разбавленные (С £ 0,01) Концентрированные (С = 1 моль/л) Насыщенные (С > 1?) По природе растворённого вещества: Электролиты (сильные (a = 1) и слабые (a < 30%)), a = распавшихся / растворённых. Неэлектролиты. По реальности: Идеальные (нет взаимодействия между AX–S, S–S, AX–AX). AX — растворённое. Реальные. Условие образования идеального раствора: DHид = 0, DS > 0, DV = 0. Растворение — физико-химический, а не механический процесс. Сопровождается тепловым эффектом и резким изменением свойств растворителя. Особенности воды как растворителя. Вода — слабый электролит; КД = (aH+aOH-) / a(H2O). CH+COH- = KД · 55,5 = K. В случае электролитов K= aH+aOH-. pH = -lg (aH+). pH = 7: нейтральная; pH < 7: кислая; pH > 7: щелочная. Сольватация — процесс взаимодействия молекул/ионов растворённого вещества с р-рителем. Процесс сольватации в зависимости от природы растворённого вещества и растворителя может привести к поляризации, ионизации и (в пределе) к диссоциации молекул растворённого вещества. AX + nS D (AX)Sn D A’Sn+ + X-Sn-. Процесс сольватации. Возможен, если DHAX–S > DHAX–AX или DHAX–S > DHS–S. Диссоциация — процесс распада растворённого вещества на свободные ионы под действием сольватации. Возможен, если DHAX–S >> DHAX–AX или DHAX–S >> DHS–S. Ассоциация — взаимодействие молекул/ионов растворённого вещества друг с другом (в чистых жидкостях и концентрированных растворах). Возможен, если DHAX–S < DHAX–AX или DHAX–S < DHS–S. Выводы. Состояние растворённого вещества в растворителе является основным фактором, определяющим свойства системы раствора. Одновременно в растворе могут находиться в равновесии все возможные формы, но возможны предельные случаи, когда в растворе находятся только ионы или только молекулы, если вещество — не электролит.
Растворы
Эбуллиоскопические и криоскопические свойства растворов. i (степеней свободы ТД системы) = число независимых компонентов системы – число фаз + 2. Смотрится по фазовой диаграмме воды. В тройной точке число фаз = 3. Закон Вант-Гоффа. Осмотическое давление P — давление, которое необходимо приложить к раствору с большей концентрацией, чтобы преодолеть транспортировку растворителя. Численно равно давлению, которое создало бы растворённое вещество, находясь в объёме раствора в газообразном состоянии при данной температуре. P = [ i ]CRT. Закон Рауля показывает зависимость давление пара растворителя от C: Для идеального раствора: Pнад раствором = p10 * x1. p10 — давление пара чистого растворителя; x1 — концентрация растворённого вещества. Для реального раствора: Pнад раствором = p10a10, а1 — активность растворённого вещества. Для неэлектролитов: DTкип = КэбСm; DTзам = КкрСm. Сm [моль/кг] — моляльная концентрация. Для реальных растворов: DTкип = iКэбСm; DTзам = iКкрСm. Изотонический коэффициент i = DTзам / кип(теор) / DTзам / кип(эксп) = DP(теор) / DP(эксп). i > 1: электролит; i = 1: неэлектролит; i < 1: ассоциат. Cm(эксп) = DТкип (эксп) / Кэб (в табл). Сm(эксп) > Сm(теор): электролит; Сm(эксп) = Сm(теор): неэлектролит; иначе ассоциат. Короче, для задач формула: i = DTзамерзания / (Ккр * Сm), где Ккр = 1,86. Среднеионный коэффициент активности g± = (g+n+ * g-n-)(n+ * n-). Активность электролита a = ··Cm ·g±. Для задач активность электролита a = g± * * Cm. Ионная сила раствора I = Ѕ åCm(i)zi2. В задачах по I дают g±. ln g± = -A|z+ * z-|*IЅ . Константа А определяется свойствами растворителя. Закон Оствальда: Константа диссоциации КД = C·2 / (1 – ). Для слабых электролитов a = (Кд/C)Ѕ. Также КД рассчитывается через активности по закону действия масс. Закон Оствальда: h = (Kг / C0)Ѕ, h — степень гидролиза, КГ — константа гидролиза.
Дисперсные системы и коллоидные растворы
Дисперсная система — гетерогенная система из двух и более фаз с сильно развитой поверхностью раздела. Дисперсионная среда (ДС) — вещество, образующее в дисперсной системе сплошную фазу. Фаза, распределённая в среде, называется дисперсной фазой (ДФ) (дисперсоидом). Коллоидные системы — системы с размером ДФ порядка 10-7 — 10-9 м. Классифицируются по агрегатному состоянию ДФ и ДС: Лиофильные коллоиды — коллоиды с высоким сродством ДФ и ДС. Нет чёткой границы фаз. Наиболее термодинамически устойчивы. Лиофобные коллоиды — с малым сродством ДФ и ДС. Резкая граница раздела фаз. Менее устойчивы. Адсорбция — процесс поглощения одного вещества поверхностью другого. Правило Пескова-Фаянса: ядро мицеллы адсорбирует из раствора преимущественно те ионы, которые входят в кристаллическую решётку ядра (или изоморфные им) и в растворе находятся в избытке. Заряд гранулы определяется как сумма зарядов потенциалообразующих ионов. Знак заряда гранулы равен знаку заряда потенциалообразующих ионов. Метод получения: 1) измельчение ДФ в ДС, 2) осаждение (конденсация) в результате обменных реакций, где выделяются труднорастворимые продукты. Пример образования мицеллы: 1) AgNO3 + KI " AgI$ + KNO3 (получение частиц ДФ размером 10-7 — 10-9 м) 2) mAgI$ (ДФ) + nAgNO3 (ДС) " {m[AgI]nAg+xNO3–}(n-x)+ (n-x)NO3–. Всё — мицелла, m[AgI] — ядро; nAg+xNO3– — адсорбционный слой, {m[AgI]nAg+xNO3–}(n-x)+ — гранула,
(n-x)NO3– — диффузионный слой. Устойчивость коллоидных систем — способность сохранять присущую им степень дисперсности. Агрегативная связана с наличием заряда одного знака у гранулы, что приводит к отталкиванию частиц и предотвращает их слипание. Кинетическая связана с постоянным броуновским движением частиц. Коагуляция — процесс слипания частиц. После коагуляции снижается устойчивость. Можно устроить коагуляцию, подействовав электролитом. Седиментация (осаждение) — выделение ДФ в виде осадка. Порог коагуляции (Спор) — наименьшая концентрация электролита, вызывающая коагуляцию. Cпор» (Cэл * Vэл)/(Vзоля + Vэл); Cпор» 1/z6, z — заряд коагулирующего иона. При коагуляции мицелл лиофильного коллоида происходит образование геля. Пример коагуляции:
 .
. 
Оптические свойства коллоидов: Эффект Тиндаля (конус) позволяет доказать наличие коллоида. Электрические свойства коллоидов обусловлены наличием заряда у гранулы. Электрофорез — направленное перемещение частиц в постоянном электрическом поле. Электроосмос — перемещение ДС через полупроницаемую перегородку в постоянном электрическом поле.
Кислотно-основные системы
Все химические системы по характеру протекающих в них реакций можно отнести либо к кислотно-основным, либо к окислительно-восстановительным. Теория Аррениуса: В чистом виде кислоты являются неэлектролитами. Кислоты становятся электролитами в воде. Водные растворы кислот изменяют окраску индикаторов. Водные растворы кислот вступают в следующие реакции: K2O + 2HCl " 2KCl + H2O Na + H2Br " H2# + 2NaBr (с активными металлами образуются соль и водород) Na2CO3 + HCl " H2CO3 + Na2SO4 (с солями слабых кислот образуется слабая кислота) Основание — вещество, вступающее с кислотами в реакцию нейтрализации. Не объясняет ряд реакций (органические, аммиак). Теория Бренстеда-Лоури (протонная): Кислота — вещество, состоящее из молекул или ионов, являющихся донором протонов. Основание — вещество, состоящее из молекул или ионов, являющихся акцептором протонов. HCl (кислота) + H2O (основание) ® H3O+ (кислота) + Cl- (основание) Чем выше сродство к протону, тем сильнее основные свойства вещества. Самое высокое сродство у аммиака.
Протофильные вещества — с высоким сродством к протону. Протогенные вещества — с низким родством к протону (HF). Амфипротонные вещества — H2O, C2H5OH. HF (кислота) + C2H5OH (основание) D + C2H5OH2 – (кислота) + F – (основание) Теория Льюиса (электронная): Кислота — вещество, принимающее электронные пары. Основание — вещество, отдающее электронные пары для образования химических связей. Основной механизм кислотно-основного взаимодействия — образование донорно-акцепторных связей. Участие протона не обязательно! (CH3)3N + BF3 D (CH3)N: BF3. Реакция комплексообразования — кислотно-основное взаимодействие, в котором центральный атом – кислота Льюиса, а лиганды – основания Льюиса. Th4+ (кислота Льюиса) + 4CO32- (основание Льюиса) D [Th(CO3)4]4-. (CO3)4 — лиганды.
Комплексные соединения
Комплексные соединения образуются в избытке электролита за счёт донорно-акцепторного взаимодействия. Условие образования комплекса: 1) избыток электролита, 2) возможность образовывать донорно-акцепторные связи между взаимодействующими молекулами, 3) наличие свободных орбиталей. Комплексообразование — процесс образования за счёт донорно-акцепторного взаимодействия устойчивого соединения, называемого комплексом. Типичные комплексообразователи и лиганды. Типичные комплексообразователи: d- и f-металлы: Cu, Fe2+, Fe3+, Co, Ni, Pf, Au, Ag, Eu, Ce, Th, U. Типичные лиганды: молекулы с неподелённой электронной парой: анионы, любые галогены: F –, OH –,CO32-, CN –, NO32-, …. Координационное число — число лиганд в комплексе. Часто бывает 4, 6, 8, 2. Вообще 2,..., 12. Дентатность — число донорных атомов лиганд, непосредственно связанных с комплексообразователем. Строение комплексного соединения. K2[Cd(CN)4]. Внутренняя сфера — Cd(CN)4. Называется комплексом. Комплексообразователь — Cd2+. Лиганды — CN –. Заряд: -2. Заряд комплекса равен суммарному заряду внешней сферы с противоположным знаком. Взаимосвязь строения комплексов и гибридизации орбиталей комплексообразователей. Гибридные орбитали возникают в результате влияния лигандов на комплексообразователь и стремления к максимальному выигрышу энергии. Между КЧ КО, типом гибридизации и геометрией существует связь:Энергетический ряд лигандов:I < Cl < F < OH < C2O4 = H2O < NH3 < SO3 < NO2. [Co(H2O)6]2+: Co2+ [ ] Тип гибридизации: sp3d2 — октаэдрический. [Co(CN)6]4–: Co2+ [ ] Тип гибридизации: sp3d2 — октаэдрический. Комплексные соединения, имеющие в своём составе внутреннюю и внешнюю сферы, диссоциируют в водных растворах практически полностью, т. е. являются сильными электролитами. Причём диссоциация комплексных ионов идёт ступенчато (как диссоциация слабых электролитов). Для каждой ступени константа равновесия называется константой нестойкости. Общая константа нестойкости равна произведению ступенчатых констант нестойкости — характеристика прочности комплекса. Чем меньше Кн, тем прочнее комплекс. Разрушение комплексных соединений. Если ПК ионов комплексообразователя и осадителя больше, чем ПР осадка, то комплекс разрушается и выпадет осадок. Приближённая оценка: сравнение констант нестойкости комплекса и ПР предполагаемого осадка. Если КН << ПР, то разрушение не произойдёт. Классификация комплексных соединений: Содержащие молекулярные монодентатные лиганды: амино- и аквакомплексы. Бидентатные: [Th(C2O4)4]4- Внутрикомплексные: диглиценат меди Двойные соли не являются комплексами: KAl(SO4)2, NH4Fe(SO4)2. Соединения, сложные по своему составу, строение которых может быть объяснено с точки зрения двойных связей.
Электрохимические процессы
Окислительно-восстановительные реакции состоят из процессов окисления и восстановления. Окисление/восстановление — отдача/принятие электронов веществом. Окислитель/восстановитель — вещество, отдающее/принимающее электроны в реакции. Степень окисления — число электронов, смещённых от атома данного элемента или к атому данного элемента в соединении. Химический способ осуществления ОВР — непосредственная передача электронов от восстановителя к окислителю. В этом случае DG < 0. Электрохимический способ осуществления ОВР. Отличается тем, что полуреакции пространственно разделены, т. е. хаотический перенос электронов преобразуется в направленный процесс переноса электронов от восстановителя через внешнюю цепь к окислителю и, как следствие этого, превращение химической энергии в электрическую. Электрохимические процессы протекают в окислительно-восстановительных (ОВ) системах, где происходят процессы превращения химической энергии в электрическую и наоборот. В основе всех ЭХП лежат процессы переноса заряженных частиц из одной фазы в другую, сопровождающиеся образованием ДЭС и разности потенциалов (электролит/электрод: электродного (ж/тв), контактного (тв/тв) и диффузионного (ж/ж)) на границе раздела фаз. Двойной электрический слой (ДЭС) — тонкий поверхностный слой из пространственно разделённых зарядов противоположных знаков, образующихся на границе раздела фаз. ДЭС образуется в результате: 1) Обмена ионами между металлом и раствором электролита. оложительные ионы из металла отрываются водой и переносятся в раствор. 2) Адсорбция ионов на поверхности электрода. 3) Выход электронов из кристаллической решётки электрода. Основные элементы электрохимической системы: Электроды (металлы, полупроводники) Электролиты с ионной проводимостью (раствор, расплав, твёрдое вещество) Граница раздела фаз (электролит | электрод).
Гальванические элементы
Проводник 1 рода — имеющий электронную проводимость. Проводник 2 рода — имеющий ионную проводимость (раствор). Электрод — проводник 1 рода, находящийся в контакте с ионным проводником. Электрод 1 рода — металл/неметалл, погружённый в раствор, содержащий ионы данного еталла/неметалла. Электрод 2 рода — металл, покрытый слоем труднорастворимой соли и погружённый в электролит, содержащий ионы этой соли. Гальванический элемент — электрохимическая система, в которой химическая энергия преобразуется в электрическую. Состоит из двух электродов, соединённых проводниками первого или второго рода в замкнутую цепь. Электродный потенциал — относительный равновесный электродный потенциал, измеренный по отношению к условной точке отсчёта ( одородного электрода = 0). 0 — относительный стандартный электродный потенциал по водородной шкале. Уравнение Нернста:  . ЭДС гальванического элемента E = jкатода – jанода = E0 + (1/z) * 0,059 * lg (aкатода / aанода). Связь ЭДС и энергии Гиббса: DG = -nFE. Отсюда можно делать выводы относительно направления протекания реакций ОВР: DG < 0: прямая реакция возможна. Правила записи гальванических элементов. В ГЭ ЭДС всегда > 0.
. ЭДС гальванического элемента E = jкатода – jанода = E0 + (1/z) * 0,059 * lg (aкатода / aанода). Связь ЭДС и энергии Гиббса: DG = -nFE. Отсюда можно делать выводы относительно направления протекания реакций ОВР: DG < 0: прямая реакция возможна. Правила записи гальванических элементов. В ГЭ ЭДС всегда > 0.
Слева записывают электрод с меньшим потенциалом. Zn- (анод) | ZnSO4 || CuSO4 | Cu (катод) Типы гальванических элементов: Стандартные: Водородный электрод. j(H+/H2) = 0. Всегда. Кислородный электрод. OH- | O2, Pt. 4OH- – 4e- D O2 + 2H2O. j = 1,277 – 0,059pH. Обратимые: ГЭ, в которых прямая токообразующая реакция и обратная (потребление электрической энергии) представляют собой одну и ту же взаимообратимую реакцию. Zn | ZnSO4 Электродные потенциалы не зависят от механизма образования двойного электрического слоя, а зависит от природы электрода и активности ионов, участвующих в электродной реакции. j0 — справочная величина (по водородной шкале). Чем больше j$0$, тем сильнее окислительные свойства. Внимание! Если один из электродов —стандартный водородный, то он записывается на первом месте: Pt, H2 | H+ || Cu2+ | Cu0, E > 0. Pt, H2 | H+ || Zn2+ | Zn0, E < 0.
Электролиз
Электролиз — процесс синтеза или разложения веществ с помощью электрического тока, О-В процесс, полуреакции которого осуществляются на отдельных электродах. В процессе электролиза катионы движутся к катоду, анионы — к аноду и на нём окисляются. Отличие от ГЭ: в ГЭ протекает самопроизвольный ОВ процесс, а при электролизе происходит процесс потребления электрической энергии. Перенапряжение (h) — величина дополнительного потенциала (напряжения) по сравнению с равновесным, необходимая для протекания электродного процесса с определённой скоростью. Для того, чтобы пошёл электролиз, величина приложенного напряжения должна превышать стандартную ЭДС. При равновесном j в системе имеет место равновесие, электролиз не идёт. Электролиз возможен при условии, что Uэлектролиза = Eравновесн + h. При электролизе перенапряжение представляет собой сумму h катода и анода. hкат смещает равновесный электродный потенциал в отрицательную сторону. hанодн смещает равновесный электродный потенциал в положительную сторону. Скорость электролиза — величина тока через единицу поверхности электрода D [А/см2]. Факторы, влияющие на h: природа, материал электрода, концентрация электролита, v ~ D. Правило электролиза: при конкурирующих процессах на катоде в первую очередь выделяется тот электролит, потенциал которого больше, а на аноде — меньше. При электролизе растворов на катоде в первую очередь разряжаются те ионы, потенциал которых с учётом h больше, а на аноде — меньше. Если анод – металл, то среди конкурирующих процессов необходимо учесть возможность растворения самого анода. При электролизе водных растворов галогенов на аноде выделяются в свободном виде галоген, а не кислород, т. к. их h << h(O2). j разряда кислородосодержащих ионов с учётом перенапряжения больше 2,5 В, поэтому их водных растворов они не разряжаются на катоде. Большие величины перенапряжения выделения водорода при разряде на некоторых активных металлах используются для получения этих металлов из водных растворов. Пример: Электролит: KI, pH = 7. Катод: Cu, h = (H2/Cu) = 0,7 V Анод: Cu, h = (H2/Cu) = 0,7 V Характеристика электролита: KI ® K+ + I-. H2O D H+ + OH-, pH = 7. Вероятные процессы на катоде и аноде: На катоде: 1)K+ + e- ® K0, j = 0j(K0/K) - h(K/K0) = –2,7 – 0 = –2,7 V. 2) 2H2O + 2e- ® H2# + 2OH- (из стр. 100). j = j0(H2/H+) - h(H2/C?) = -0,4 V. j1 < j2 Þ На катоде в первую очередь пойдёт процесс 2. На аноде: 3) 2I- – 2e ® I2, j = j0(I2/I) + h(I2) = 0,54. Пойдёт этот. 4) 2H20 – 4e D O2 + 2H2, j = j0(O2/O-2) + h(O2/Cu) = 0,814 + 1,1 = 1,914 V. Уравнение электролиза (2) + (3): 2H2O + 2e + 2I- - 2e ® электролиз ® H2# + 2OH- + I2.
Коррозия металлов
Коррозия — разрушение металла (редко материала) в результате химического (электрохимического) воздействия. Химическая коррозия — разрушение металла под действием окислителей окружающей среды, если среда не электропроводна. Скорости химической коррозии зависит от скорости диффузии газа через поверхность плёнки к металлу, а также от встречной диффузии металла. Электрохимическая коррозия — процессы окисления и восстановления пространственно разделены. Возникает в химических средах с ионной проводимостью при наличии контакта разнородных металлов за счёт образования гальванических микроэлементов. При коррозии происходит анодное растворение металла за счёт катодного восстановления окислителя среды H+ (pH < 7) и O2?(pH ³ 7) При коррозии скорость более активного металла возрастает, а менее активного — убывает. Процесс коррозии пойдёт амопроизвольно, если jок > jаосст. Методы защиты о коррозии: Покрытие металлом: более активный металл является защитным для основного независимо от дефектов. Покрытие железа цинком. Zn – 2e ® Zn2+; 2H+ + 2e ® H2 Покрытие неметаллом: только при отсутствии дефектов.
План характеристики свойств элемента
Анализ структуры группы. Электронная формула элемента и его аналогов: Анализ свойств элементов подгруппы в зависимости от электронного строения. Изменение радиуса в атоме и у элементов подгруппы.
Изменение электроотрицательности j0, характеристика О-В свойств (если металл — активность, неметалл — характеристика О-И свойств в различных степенях окисления). Свойства соединений:
Основные степени окисления (из электронного строения) Основные соединения в этих степенях окисления и их растворимость Растворимость солей Электролитическая диссоциация кислот/оснований
Гидролиз солей Возможность участия в ОВР (указать степени окисления для окислителя и восстановителя) Возможность комплексообразования Применение, получение, особенности элемента.
Водород
Водород — простейший элемент в ПСХЭ. Его строение — 1H 1S1. Особенности электронного строения: единственный электрон атома находится в сфере действия ядра. H+ — элементарная частица (протон) Количество соединений водорода — больше миллиона, основное соединение: H2O. 411H ® 24He + 2e+ + 2n + 26,7 МэВ. Термоядерная реакция. 2H ® H2 (#$) — параводород (75%), Ткип = 20,41. 2H ® H2 (##) — ортоводород (25%), Ткип = 20,49. Изотопы водорода: Протий 12H — 99,985% Дейтерий 12H — 0,015% Тритий 12H — 0%. Искусственный элемент, tЅ. D2O — мёртвая вода. Химические свойства: H — H. Есв = 431 КДж/моль. Прочная, при н. у. взаимодействует только с фтором. H2 + F2 ® 2HF. В атомарном состоянии водород чрезвычайно активен. Окислитель при взаимодействии с активными металлами. 2Na + H2 ® 2NaH-1 H2 + 2e D 2H- Na0 -1e D Na+. Восстановитель (большинство реакций). При нагревании взаимодействует со всеми неметаллами. H2) -2e D 2H+. Свойства соединений водорода. Ионные гидриды (s-металлы) — NaH2, LiH. Соединения имеют ионный характер. Под действием молекул воды полностью гидрализуются. CaH2 + H2O ® Ca(OH)2 + H2#. Металлоподобные гидриды (d- и f- металлы). Обычно не имеют стехиометрического состава и имеют нестехиометрические индексы (ZrH1,97). Не гидрализуются. Ковалентные (неполярные) гидриды. Взаимодействуют с неметаллами. H2S, AsH3, PH3, SiH4, CH4. PH3 + H20 ® HPO2 + H2#. Получение водорода. В лабораторных условиях: 1) Zn + HCl ® ZnCl2 + H2#. 2) Гидролиз водных гидридов: NaH + H2O ® H2 ® NaOH. 3) Электролиз H2O ® H2O ® H2 + O2. NaCl + H2O ® H2# + Cl2 + NaOH. Промышленные способы: 2СH4 + O2 ® (t = 900) ® CO + 4H2#. CH4 + O2 + 2H2O ® (t=800) ® CO2# + H2#. Применение: Получение аммиака: N2 + 3H2# D 2NH3. Получение тугоплавких металлов из их оксидов: MexOy + H2 ® Me2 + H2O.
s-элементы первой и второй групп
1) Сходство. S-металлы 1/2 групп имеют на последнем энергетическом уровне 1/2 электрона соответственно. Предыдущий уровень полностью завершён и стабилен, и оказывает экранирующее действие на валентные электроны. В результате этого экранирующего действия S-металлы 1 и 2 групп являются самыми активными металлами (и одновременно восстановителями). Вследствие своей активности s-металлы встречаются только в виде соединений. Начиная с 4 периода начинается нарушение монотонного изменения свойств в результате появления (n-1)d-подуровня и скачкообразные изменения таких свойств, как tпл и др. Особенности свойств лития и бериллия. Li и Be имеют особые свойства (меньшую химическую активность) из-за особого электронного строения (пред. слой из 2 электронов, внешние электроны находятся близко к ядру Þ Be амф. 2) Химические свойства s-металлов. Активные металлы без дополнительного инициирования взаимодействуют со всеми неметаллами с выделением большого количества энергии. С неметаллами: Кислород: 1 гр) 4Na+O2®2Na2O. 2 гр) 2Ba + O2 ® 2Ba2O Li + O2 ® Li2O (менее активен). Образование оксидов характерно только для Li. (K, Rb, Cs) + O2 ® Э2O2 (пероксид), (C, Ba) — пероксид, оксид. (Be, Mg) — только оксид. K + O2 ® K2O4. Суперпероксид. Азот: 1 гр) Na + N2 ® Na3N 2 гр) Mg + N2 ® (t) ® Mg3Nn. Водород: 2Na + H2 ® 2NaH Ca + H2 ® CaH2 CaH2 + H2O ® Ca(OH)2$ + H2. С водой: протекают бурно ® Э(OH) + H2# Цезий и рубидий взрываются.. Me + 2H2O ® 2MeOР + H2#. Me + 2H2O ® Me(OH)2 + H2# (кроме Be, Mg). Be(OH)2 (амф) + 2HCl ® BeCl + 2H2O. Be(OH)2 + 2NaOH ® Na2[Be2+(OH)4]2- + 4H2O. Растворимость солей: Na+ + K3[Sb(OH)6] ® Na3[Sb(OH)6]$ + 3K+. K+ + ClO4 ® KCLO4$ Li+ + (F-, PO43-, CO32-). Нет переменных степеней окисления ни у 1S, ни у 2S элементов Þ нет реакций с изменением степени окисления, но сами металлы являются восстановителями: TiO2 + Ca ® (t) ® Ti$ + 2CaO. И ещё: Na2O2 + CO2 ® Na2CO3 + O2#; Na2O2 + H2O ® NaOH + O2#. Получение: Электролиз: только расплавов (электродный потенциал» -2). 2NaCl ® Na$ + Cl2. Исключение: Be, Mg. Металлотермия: только для Be и Mg. BeO + Mg ® (t) ® Be$ + MgO; BeO + C ® (t) ® Be$ + CO; MgO + C ® Mg$ + CO. Применение:
Li, Be, Mg используются в качестве добавок к редким сплавам и придают им свойство жаропрочности. Используются в атомной области (67Li + 01n ® 13T + 24He). B идёт на производство сплавов в космической технике, используется для инициирования ядерной реакции.
d-элементы первой и второй групп
1) Электронное строение 1 гр) Э [ ] (n-1)d9nS2 2 гр) Э [ ] (n-1)d10nS2. Степень окисления +2. Несмотря на одинаковое строение внешних электронных оболочек, энергия ионизации для d-металлов куда выше, чем для соответствующих s-металлов. Это объясняется проникновением внешних s-электронов под экран (n-1) 10 электронов. Поэтому d-металлы химически гораздо более активны, чем соответствующие s-металлы. В подгруппе с ростом заряда ядра эффект проникновения усиливается, что приводит к ослаблению химической активности металла. Химические свойства. 1 гр) с O2 не взаимодействуют. Только 2Cu + O2 ® (high t) ® 2CuO c H2O не вз 2 гр) Zn + O2 ® ZnO с H2O не взаимодействуют. Zn + H2O ® H2 +Zn(OH)2 Cu + Cl2 ® CuCl2. Кислотно-основные свойства. 1 гр) Cu(OH)2 — основные свойства 2 гр) Zn(OH)2 — амфотерен. Cu(OH)2 + 2HCl ® CuCl2 + H2O. C(OH)2 + NaOH не идёт. Zn(OH)2 + 2HCl ® ZnCl2 + H2O. Zn(OH)2 + NaOH ® Na2ZnO2 + H2O (or ® Na2[Zn(OH)4]. Cd2+, Hg2+ + NaOH не идёт. Комплексообразование. CaSO4 + 4NH4OH ® [Cu(NH3)4] + 4H2O. Cu + 4HCl (конц) ® H[Cu+Cl2] + H2#. Ag+1Cl ® NH4OH ® [Ag(NH3)4]Cl + 2H2O. AuCl3 + HCl ® H[AuCl4]. ZnCl2 + NH4OH ® [Zn(NH3)4]Cl2 + H2O. Окислительно-восстановительные свойства. Cu, Ag, Au + разб не идёт. Сu + H2SO4 ® (O2) ® CuSO4 + H2. Сu + 2H2SO4 (конц) ® CuSO4 + SO2 + 2H2O. Cu + 8HNO3 ® 2NO + 3Cu(NO3)2 + 7H2O. Ag + 2HNO3 (конц) ® NO2 + AgNO3 + H2O. 3HCl + HNO3 ® 2Cl + NOCl + H2O. Царская водка. 1 ст) Au + 3Cl ® AuCl3 AuCl3 + HCl ® H[AuCl4] Au + 3HCl + HNO3 ® H[AuCL4] (раствор) Получение. Электролиз раствора. В лекции нет.
Жёсткость воды
Труднорастворимые SO42- и CO32- 2s элементов приводят к жёсткости воды. Жёсткость воды — наличие в ней солей кальция и магния. Измеряется в [мМоль/л]. Мягкая: < 2; Средняя: 2 — 10; Жёсткая: > 10. Карбонатная: Ca(HCO3); Mg(HCO3)2. Методы устранения жёсткости воды: Кипячение: Ca(HCO3) ® (t) ® CaCO3 (накипь) + H2O + CO2#. Высаливание: CaSO4 + Na2SO3 + CaCO3$ + Na2SO4. Ионный обмен: RSO3H + Ca2+ ® (RSO3)2Ca + 2H+. ROH + SO42- ® R2SO4 + 2OH-.
Третья группа ПСХЭ
Главная подгруппа: p-элементы (B (неме), Al, Ga, In, Tl (ме)). [ ] nS2nP1 Þ +3. Побочная подгруппа: d-элементы (Sc, Y, La. Ac). [ ] (n-1)d1nS2. f-элементы: лантаноиды (Сe — Lu) [ ] 4f1-14 [ ]5d16S2; актиноиды (Th — Lr) [ ] 5f1-14 [ ]6d17S2 Общие свойства элементов III группы. Все элементы 3 группы имеют основную валентность 3 (степень окисления +3), и состав их соединений в этой степени окисления аналогичен: B2O3, In2O3, Y2O3. Все элементы характеризуются металлическими свойствами: Y(OH)3, Eu(OH)3, Al(OH)3, H3BO3. Для оксидов и гидроксидов, как правило, проявляются основные свойства. Все соединения III группы имеют подобные растворимые (хлориды) и нерастворимые (гидроксиды, фториды, карбониды, оксолаты) соединения. Различия между элементами главной и побочной подгрупп. 1) Элементы главной подгруппы имеют иное электронное строение внешнего слоя (p-электроны) Þ их металлы будут менее активными. Наличие одного электрона на p-подуровне ослабляет металлические свойства элементов главной подгруппы. 2) Элементы побочных подгрупп (d- и f-) на внешнем слое имеют nS2 электроны и являются типичными металлами.
d-элементы III группы побочной подгруппы (Sc, Y, La)
Sc, Y, La ® Усиление металлических свойств. Взаимодействие с O2: 4Sс + 3O2 ® 2Sc2O3. Защитная плёнка (и для Y). 4La + 3O2 ® La2O3. Порошкообразный, не защищает. При растворении в воде образуют гидроксиды: Me + 6H2O ® Me(OH)3 + 3H2#. 8Sc + 30HNO3 ® 3NH4NO3 + 8Sc(NO3)3 + 9H2O. Sc0 – 3e D Se3+; N+5 + 8e D N-3. Амфотерность: Y, La, Ac — неамфотерны + NaOH не идёт. 2Sc + 2NaOH + 4H2O ® H2 + 2NaScO2. 2H+ + 2e D H2; Se – 3e D Se3+. Растворимость: Растворимы: Э(NO3)3; Э(SO)3; ЭCl3; ЭBr3. Нерастворимы: Э(OH)3; ЭF3; ЭPO4; Э2(C2O4)3. Комплексообразование: Sc (КЧ = 6); Y (КЧ = 8); La (КЧ = 8/9). Реакции комплексообразования позволяют отделить некоторые элементы от других, неспособных образовывать комплекс в аналогичных условиях: Отделение Sc3+ от других Э3+. Отделение от других трёхвалентных элементов основано на том, что Sc способен образовывать комплекс с ионом F-. ScF3$ + 3NH4F ® (NH4)3[ScF6]3- (раствор). (La/Y)F3 + NH4F3 не идёт. Гидролиз. Э3+ — слабое основание: ЭCl3 + H2# + H2O D Э(OH)CL2 + HCl. ЭÎ{Y, La}. Получение. Термическое разложение: Y2(C2O4)3 ® (t) ® Y2O3 + CO2 + CO3. Y2(CO3)3 ® Y2O3$ ® 3CO2# Металлотермия: кальцийтермия и магнийтермия 2YF3 + 3Ca ® (t) ® 2Y$ + 3CaF2 Y2O3 + Mg ® (t > tплавл) ® 2Y$ + 3MgO Электролиз. Только расплава: LaCl3 ® (t» 850) ® La$ + 3/2 Cl2#.
f-элементы III группы (лантаноиды)
Лантаноиды: Ce — Lu. Заполнение 4f. [ ] 4f1-14 [ ]5d16S2. Степень окисления +3. Аналоги d-эл 3 гр. Особенности свойств лантаноидов. Некоторые лантаноиды имеют переменную степень окисления, что вызвано стремлением их атомов приобрести устойчивую конфигурацию f-подуровня (4f0, 4f7, 4f14).
E(4f)» E(5f) Þ между электронами на этих подуровнях возможен обратный переход с образованием устойчивой электронной конйигурации. Переменную валентность имеют Ce (+3, +4), Eu (+3, +2), Tb (+3, +4), Yb (+2, +3). Эффект лантаноидного сжатия проявляется в том, что в ряду лантаноидов по мере увеличения заряда ядра уменьшается радиус атома. Это связано с тем, что заполняемый подуровень (4f) находится в глубине. Близкие размерные факторы — основа для объёдинения элементов в редкоземельные (РЗЭ): 16 элементов: 14 лантаноидов, Y и La. Химические свойства зависят от строения внешнего энергетического уровня и радиуса атома. Близость атомного радиуса обусловливают аналогичные свойства этих элементов и являются причиной трудности разделения лантаноидов. Редкоземельные элементы. Две группы: цериевая (La, Ce — Cd), иттриевая (Y, Tb — Lu).
Свойства церия
58Ce [ ] 4f1 [ ] 5d16s2. Степень окисления +3, аналог d-элементов III группы. 58Ce [ ] 4f0 [ ] 5d26s2. Степень окисления +4, аналог d-элементов 4 группы (Ti, Zr, Hf). Ce3+ — восстановитель. Ce3+ + окислитель ® Ce4+. 3Ce(OH)3$ + KMnO4 + 2H2O ® (ph > 7) ® 3Ce(OH)4$ + MnO2 + KOH Качественные реакции на ион церия: Ce(OH)4 + H2O2 ® (pH > 7) ® Ce(OH)4$ (жёлт), а затем Ce(OH)4 + H2O ® (pH > 7) ® Ce (OOH)4$ (оранж). Ce(NO3) + 3NH4OH ® Ce(OH)3$ + 3NH4NO3 Ce(OH)4 + H2O2 ® (pH<7) ® O2# + Ce2(SO4)3. ОВР. 2Ce(OH)4 + H2O2 + 3H2SO4 ® (ph = 7) ® Ce2(SO4)3 + O2# + 4H2O. ОВР. Ce2(C2O4)3 + O2 ® (t) ® CeO2 + 6CO2. ОВР. Hard! Ce4+ — окислитель. Ce4+ + восстановитель ® Ce3+. При pH < 7. 2Ce(OH)4 + 8HCl ® Cl2 + 2CeCl3 + 7H2O. 2Ce(SO4)2 + 2KI- ® Ce2(SO4)3 + I2 + K2SO4. Ce+4(SO4)2 + H2O2 ® Ce2+3(SO4)3 + O2 + H2SO4. Кислотно-основные свойства Ce4+. Основные: Ce(OH)4 + H2SO4 ® Ce(SO4)2 + 2H2O. 2Ce(OH)3 + 3H2SO4 ® Ce2(SO4)3 + 3H2O. Кислотные: Ce+4(OH)4 + NaOH ® Na2CeO3 + H2O. Ce(OH)3 + NaOH не идёт. Отделение церия от других редкоземельных элементов. В основе — способность церия обладать степенью окисления +4. Ce(OH)4$ + HCl ® (pH = 1,5) ® 2CeCl3 + Cl2 + 8H2O. Ce(OH)3$ + HCl ® CeCl3 + 3H2O. R(OH)3$ + HCl ® (pH = 6,5) ® RCl3 + 3H2O. Комплексообразование — один из способов отделения. Церий, в отличие от других редкоземельных элементов, в степени окисления +3 способен образовывать комплексы с КЧ = 8 (растворы оксолатов и карбонатов). Ce(C2O4)2$ + (NH4)C2O4 ® (NH4)[Ce+4(C2O4)]4-. Na2/R2/Ce2(C2O4)3$ + (NH4)C2O4 не идёт.
Свойства соединений церия в различных степенях окисления
Свойства соединений церия Ce3+. Ce(NO3)3+3NaOH ® Ce(OH)3¯+3NaNO3; Ce(OH)3¯+3HCl®CeCl3+3H2O;
Ce(OH)3¯+NaOH¹; 2Ce(NO3)3+3(NH4)C2O4®Ce2(C2O4)3¯(бел)+6NH4NO3; Ce(NO3)3+3Na2CO3 ®Ce2(C2O4)3¯(бел)+6NaNO3; Ce(NO3)3+3NaF®CeF3¯(бел)+3NaNO3; Ce(NO3)3+Na3PO4 ®CePO4¯(бел)+3NaNO3; NaBi+5O3¯+6HNO3+2Ce(NO3)3® 2Ce(NO3)4(желт)+Bi+3(NO3)3+NaNO3+3H2O Bi+5+2e®Bi+3 окислитель Eок=1.86 В Ce+3-e®Ce+4 восстановитель Eвос=161 В E = Eок-Eвос = 0,25 В. Св-ва соединений церия Ce 4+. Ce(SO4)2(жёлтый р-р)+4NaOH®Ce(OH)4¯+2Na2SO4; Ce(OH)4+NaOH¹водный р-р; Ce(OH)4+2NaON®t°Na2CeO3+3H2O; Ce(OH)4¯+2H2SO4® Ce(SO4)2+4H2O; 2Ce+4(OH)4+8HCl-1®2Ce+3Cl3+Cl2+8H2O Ce+4+e®Ce+3 окислитель xок=1.61 В 2Cl-1-2e®Cl20 восстановитель xвост=1.36 В; 2Ce(SO4)2+KI®pH<7I2+K2SO4+Ce2(SO4)3 Ce+4+e®Ce+3 окислитель xок=1.61 В 2I--2e®I2 восстановитель xвост=-0.54; 2Ce(SO4)2+H2O2®Ce2(SO4)3+O2+H2SO4 Ce+4+e®Ce+3 окислитель xок=1.61 В 2O-1-2e®O20 восстановитель xвост=1.23 В. Качественные реакции на ионы церия. Ce(NO3)3+3NH4OH® Ce(OH)3¯+3NH4NO3; 2Ce(OH)3+H2O2®Ce(OH)4¯; Ce(OH)4¯+H2O2®Ce(OH)3(OOH)¯+H2O.
Свойства европия.
Электронное строение. Eu [ ] 4f6 [ ] 5d16s2. +3. Аналог R+3 РЗ (4f), некоторых 3d (Sc, La, Y, Ac).
Eu [ ] 4f7 [ ] 5d06s2. +2. (Ca, B). EuSO4$. Окислительно-восстановительные свойства. Eu2+ D Eu3+. Eu2(SO4)3 + Zn ® (pH < 7) ® 2EuSO4$ + ZnSO4. Отделение Eu от других редкоземельных элементов связано с его способностью образовывать труднорастворимый сульфат в двухвалентном состоянии: R2(SO4)3 — раствор. Кислотно-основные свойства европия. Eu(OH)3 + 3HCl ® EuCl3 + 3H2O Eu + 2H2O ® Eu(OH)2 + H2#. Eu(OH)2+H2SO4 ® EuSO4$ + H2O Eu(OH)3/2 + NaOH ¹. CeC + H2O ® Ce(OH)4$ + CH4.
CeC2 + H2O ® Ce(OH)4$ + C2H4. EuC2 + H2O ® Ce(OH)2$ + Eu2C2. CaC2 + H2O ® Ca(OH)2 + C2H2.
Методы получения лантаноидов
Выделение лантаноидов в чистом виде с помощью электролиза невозможно. Идёт электролиз воды. оказательство: LaCl3 D La3+ + 3Cl-. H2O D H+ + OH-. На катоде: La3+ + 3e " La0 j1 = -2,522 2H2O + 2e D H2# + 2OH– j2 = -0,413. Идёт. На аноде: 2Cl– -2e " Cl20 j3 = 1,36. На самом деле идёт этот. 2H2O - 4e D O2# + 4H+ j2 = 0,814 + h. Итого: 2Cl- + 2H2O " H2# + 2OH- + Cl2#. 2LaCl3 + 6H2O " 3H2# + 3Cl2# + 2La(OH)3$. Þ Þ Выделение лантаноидов в чистом виде с помощью электролиза невозможно. #.
На практике применяют следующее: Термическое разложение. La2(C2O4)3 ® (t) ® La2O3$ + 3CO2 + 3CO
La2(CO3)3 ® (t) ® La2O3$ + 3CO2#. Металлотермия. La2O3 + 3Mg ® (t > tпл) ® 2La + 3MgO. Электролиз расплавов галогенидом. LaCl3 ® (электролиз, t» 850c) ® La$ (на катоде) + (3/2)Cl2# (на аноде).
Актиноиды
Особенности. Электронное строение: Э [ ] 5f1-14 [ ] 6d17s2. Наиболее тяжелые элементы следуют за актинием. Все элементы претерпевают радиоактивный распад. E (5f)» E(6d), близко к ядру Þ степени окисления Î [+3, +7]. Th (+4), Pa (+5), U (+6), Np (+6), Pu (+7), Am (+6), Cm (+4). Актиноидное сжатие.
Свойства тория.
Th [ ] 5f1 [ ] 6d17s2, +3, аналог R Th [ ] 5f0 [ ] 6d27s2, +4, аналог 4d: Zr, Hf. Th + O2 ® ThO2. Взрыв. Получение: Th3(PO4)4$ + 12NaOH ® (t) ® 3Th(OH)4 + 4Na3PO4. Свойства соединений тория Th+4. Th(NO3)4 + 4NaOH " Th(OH)4¯ + 4NaNO3. Th(OH)4 + NaOH ¹. Th(OH)4¯ + 4HCl ® ThCl4 + 4H2O. Th(NO3)4 + 2Na2CO3 + H2O ® ThOCO3¯ + 4NANO3 + H2O + CO2. ThOCO3 + 3Na2CO3 + H2O ® Na4[Th(CO3)4] + 2NaOH. КЧ=8. Th(NO3)4 + 2(NH4)C2O4 ® Th(C2O4)2¯ + 4NH4NO3. Th(C2O4)2¯ + 2(NH4)C2O4 ® (NH4)4[Th(C2O4)4] КЧ=8. ThF4¯ + 4Na2CO3 ® Na4[Th(CO3)4] + 4NaF. Th(NO3)4 + K4[Fe(CN)6] ® Th[Fe(CN)6]¯ + 4KNO3. Th[Fe(CN)6]¯ + 4Na2CO3 ® Na4[Th(CO3)4] + Na4[Fe(CN)6]. Качественные реакции на Th + 4. Th(NO3)4 + HCl + ”торон”® соединение малинового цвета. H2O + HCl + ”торон”® соединение оранжевого цвета. Отделение тория. От Ce3+ и R3+. Кислотно-основное: R(OH)3$ + 3HCl ® (pH = 6,5) ® RCl3 + 3H2O. Th(OH)4$ + 4HCl ® (pH = 3) ® ThCl4 + 4H2O. 2Ce(OH)3$ + 8HCl ® (pH = 1) ® 2CeCl3 + Cl2 + H2O. Комплексообразование (Th4+ — мощный комплексообразователь): ThCl4 + (NH4)2C2O4 ® (NH4)4[Th[C2O4)4] + 4NH4Cl RCl3 + 3(NH4)2C2O4 ® R2(C2O4)3$ + 3NH4Cl. От (U+6O2)2+, Th4+. На образовании труднорастворимых фторидов: ThCl4 + 4KF ® ThF4$ + 4KCl
UO2Cl2 + KF ® UO2F2 (раствор) + KCl На комплексообразовании: ThCl4 + 4(NH4)2C2O4 ® NH4)4[Th4+(C2O4)4]4- + 4NH4Cl. 2RCl3 + Na2C2O4 ® R2(C2O4)$ + NaCl. От U+6: ThCl4 + 4KF ® ThF4$ + 4KCl. UO2Cl2 + 2KF ® UO2F2 (раствор) ® 2KCl. Получение тория. Th(C2O4)2 ® (t) ® ThO2$ + 2CO# + 2CO2#. Металлотермия: ThO2 + Ca ® (t) ® Th$ + CaO. Без воды. Иначе взрыв. Электролиз расплава: K2[ThF6] (KCl, NaCl) ® Th$ (порошкообразный) + Cl2#. Иодидное рафинирование (газотранспортные реакции): ThI4 D Th + 2I2. ThO2/Th3N4/ThC+I2 не идёт. 1 зона: Th + I2 ® (t) ® ThI4 (газ) ® во вторую зону. 2 зона: ThI4 ® (t) ® Th$ (чистый) + 2I2.
Свойства урана.
U [ ] 5f3 [ ] 6d17s2, +3 (малоустойчив, аналог R3+) U [ ] 5f2 [ ] 6d27s2, +4 (уст, аналог Th, Ti, Zr. Hf) U [ ] 5f1 [ ] 6d37s2, +5 (неустойчив) U [ ] 5f0 [ ] 6d47s2, +6, (аналог Cr+6, Mo+6, W+6, [S+6]). Свойства металлического урана. Активен! j (U+4/U) = -1,2 V. a — распад. tполураспада = 4*109, tплавл = 1100с. U + O2 ® UO2; 2U + 3O2 ® 2UO2; 3U + 4O2 ® U3O8 – защитная плёнка. 2U + N2 ® 2UN; U + 2C ® UC2; U + 3Cl ® UCl6; U + 3F2 ® UF6. UCl6 и UF6 — летучие газообразные. Химические свойства урана. U+3 (аналог R3+) D U+4 (аналог Th4+) D U+6. Свойства U+6. U+6 амфотерен и в растворе не присутствует никогда. Пример амфотерности: 5U(SO4)2 + 2KMnO4 + 2H2O ® (pH < 7) ® 5UO2SO4 + 2MnSo4 + K2SO4 + 2H2SO4. 2U(SO4)2 + Zn (восст) ® U2(SO4)3 + ZnSO4 Качественная реакция на U4+. U(SO4)2 + KF ® UF4$ + K2SO4 U(SO4)2 + K4[Fe(CN)6] ® U[Fe(CN)6]. Гидролиз солей U+6. U+6 + H2O D U(OH)4+2 + 4H+, pH < 7. UO2(OH2) (основание) D H2UO4 (кислота). U+6 амфотерен. Примеры: Взаимодействие с кислотами: UO2(OH)2 + H2"O4 ® UO2"O4 + H2O. Взаимодействие с основаниями: 2UO2(OH)2 + 2NaOH ® Na2U2O7$ + 2H2O. Растворимость. Растворимы: UO2SO4, UO2Cl2, UO2(NO3)2. Нерастворимы: UO2(OH)2, MeU2O7 (Me: NH4+, Na+), UO2HPO4. Качественная реакция на U4+. U(SO4)2 + KF ® UF4$ + K2SO4 UO2SO4 + K4[Fe(CN)6] ® (UO2)[Fe(CN)6] (тёмно-коричневый)+ 2K2SO4. (UO2)2[Fe(CN)] + 6NaOH ® Na2U2O7$ + Na4[Fe(CN)6]. Качественные реакция на ион диоксоурана UO22+. 2UO2(NO3)2 + K4[Fe(CN)6] ® (UO2)2[Fe(CN)6]¯(кор) + 4KNO3 (UO2)2[Fe(CN)6]¯ + 6Na(OH)(изб) ® Na2U2O7¯жёлт + Na4[Fe(CN)6] + 3H2O. Комплексообразование. Na2U2O$ + 6NaCO3 + 3H2O ® 2Na4[UO2{CO3)3]. UO2SO4 (окислитель) + Zn + 2H2SO4 ® U(SO4)2 + ZnSO4 + 2H2O. Очистка урана. (примеси — Ra) U3O8 + MnO2 + 4H2SO ® 3UO2SO4 (раствор + примеси) + MnSO4 + 4H2O. 1) Ra2+ + H2SO4 ® RaSO4$ + 2H+. Очистка от активных примесей. 2) UO2SO4 + 3Na2CO3 ® Na4[UO2(CO3)32-] + Na2SO4. Карбонатная очистка. Очистка урана от тория: 1 ст). Сорбция на твёрдом катиониде. Th4+ + 4RHSO3 ® Th(RSO3)$ + 4H+. UO22+ + 2RHSO3 ® UO2(RSO3)2$ + 2H+. 2 ст) Десорбция. В качестве десорбента используют раствор кислоты HCl разной концентрации, который подбирается так, чтобы десорбция катионов происходила селективно (только по одному катиону). См. рис. Получение урана. Na4[UO2(CO3)3 + 3H2SO4 ® UO2SO4 + 3U2CO3 + 2Na2SO4 Осаждение) UO2SO4 + 2NaOH (мало) ® UO2(OH)2$ + 2Na2SO4 Термическое разложение) UO2(OH)2 ® (t) ® UO3 + H2O# Восстановление) U+6O3 + H2 ® U+4O2 + H2O Синтез фторида) UO2 + HF ® (t = 600c) ® UF4 + 2H2O Металлотермия) UF4 + Ca ® (t > Tпл) ® U$(плавл) + CaF2.
Свойства соединений урана U+6.
UO2(NO3)2+2NaOH(мало)®UO2(OH)2¯+2NaNO3. UO2(OH)2¯+2NaOH(изб)®Na2U2O7¯+3H2O. Na2U2O7¯+6Na2CO3+3H2O®2Na4[UO2(CO3)3]+6NaOH. КЧ=6; UO2SO4+Zn+2H2SO4®U(SO4)2+ZnO4+2H2O
UO2SO4+NaF«UO2F2+Na2SO4. U(SO4)2+4NaF®UF4¯+2Na2SO4. 2UO2SO4+K4[Fe(CN)6]®(UO2)2[Fe(CN)6]¯+2K2SO4. U(SO4)2+K4[Fe(CN)6]®U[Fe(CN)6]¯ +2K2SO4.
Разделение элементов
Классификация методов разделения. По целевому назначению: Методы грубого (предварительного) разделения Получение чистых и особо чистых веществ Химические методы защиты окружающей среды от вредных примесей. По целевому назначению?: Химические Физико-химические Физические Химические методы разделения и очистки веществ. Методы используют различия в константах скорости реакций. Осаждение. Метод основан на различной растворимости компонентов раствора. Процесс осаждения зависит от состава водной фазы, pH – среды, температуры, последовательности смешивания растворов. В некоторых случаях процесс осаждения осложняется образованием коллоидных растворов или осаждением примеси с основными элементами. Требования к реакциям осаждения: Образование стехиометрически определённых соединений. Проведение реакций лишь в тех условиях, когда отсутствует соосаждение и образование коллоидных систем. Лёгкость доведения осадка для обеззараживания промышленных стоков и очистки их от примесей тяжёлых элементов. При значениях pH Î [4, 7] практически все тяжёлые металлы образуют труднорастворимые гидроксиды. Осаждение гидроксидов различных металлов. Чем сильнее гидроксид, тем выше pH. При pH>7 Отделение металлов за счёт способности образовывать осадки. Sc от трёхвалентных РЗ эл-тов Sc3+(NO3)3 + 3KF ® ScF3$ + 3KNO3 R3+(NO3)3 + 3KF ® RF3$ + KNO3 ScF3 + 3KF ® K3[ScF6] RF3 + KF не идёт. Цементация — выделение металла из растворов их солей более активными металлами Электродный потенциал металла должен быть больше, чем ЭП выделяемого металла. CdSO4 + Zn ® Cd$ + ZnSO4. CuSO4 + Fe ® Cu$ + FeSO4. 2EuCl3 + Zn + 3H2SO4 ® 2Eu$ + ZnSO4 + 6HCl 3MnSO4 + 2KMnO4 + 2H2O ® 5MnO2$ + K2SO4 + 2H2SO4. CeCl3 + KMNO4 + *NaOH + 2H2O ® Ce(OH)4$ + MnO2 + KCl + 8NaCl Ag+ + Cl- ® AgCl$; K+ + ClO4- ® KClO4; Ba2+ + SO4- ® BaSO4. Реакции растворения: Th4+ + C2O4 ® [Th(C2O4)4]4- (раствор) La+3 + C2O42- ® La2(C2O4)3$.26
Физические методы разделения
Кристаллизация, зонная плавка, термодиффузия, ретификация. Кристаллизация — процесс образования и роста кристалла из раствора, расплава или газа. Происходит с разной скоростью за счёт создания еравновесных условий (перенасыщение или переохлаждение раствора). Отделение Zr и Hf. ногоступенчатая фракционная кристаллизация основана на растворении солей Zr и Hf (у K2[HfF4] растворимость в 2–4 раза выше, чем у K2[ZnF6]. Зонная плавка — бестигельная кристаллизация. Единственный однофазный метод. Термодиффузия — стеклянная трубка, один конец которой нагрет, другой охлаждён. Разность концентраций газообразных веществ создаётся за счёт различия коэффициента диффузии в температурном поле. Используется для разделения изотопов урана в виде летучего UF6. Дистилляция (перегонка). Разделение жидких смесей, основанное на различии состава жидкости и состава равновесного с ней пара.
Химические транспортные реакции
В основе метода лежат обратимые гетерогенные реакции, сопровождающиеся переносом очищаемого вещества из одной температурной зоны (T1) в другую (T2) с более высокой температурой. в результате образования и разложения газообразных промежуточных соединений. Широко применяются газообразные иодиды металлов. Иодидное рафинирование: Meтв + (n/2)I2 D MeIn(г). Основные стадии транспортных реакций: 1) Образование летучего продукта из твёрдого металла и газообразного реагента в низкотемпературной зоне. Zr + 2I2 ® ZrI4 (г) 2) Транспорт летучего соединения из зоны T1 в зону T2. 3) Разложение летучего соединения на чистый металл и газообразный реагент, который возвращается в зону T1: ZrI4 (г) ® (T2) ® Zr$ (чистый) + I2. Достоинство метода: возможность глубокой очистки от O2, N2, H2, C2, т. к. в аналогичных условиях иод не реагирует с оксидам, нитридами, карбидами, гидридами и пр. Экстракция — процесс извлечения вещества из одной жидкой фазы в другую. Как правило, одна фаза — вода, другая — органическая. В основе метода лежит закон распределения вещества между двумя несмешивающимися жидкостями. ТД константа распределения K = aa(орг) / aa(неорг) = сa(орг) / ca(орг) = D. В случае, когда коэффициент активности можно заменить концентрацией (растворы электролитов/предельно разбавленные растворы), в системе выполняется предельный закон Бертло-Нернста. Закон: растворённое вещество распределяется между двумя несмешивающимися жидкостями таким образом, что отношение равновесных концентраций вещества A в обеих фазах не зависит от общей концентрации растворённого вещества при условии, что в каждой фазе вещество имеет одну и ту же молекулярную массу. В случае диссоциации (ассоциации) в растворах выражение закона усложняется. В экстракции может происходить процесс комплексообразования. ТБФ (трибутилфосфат) + [UO2(H2O)6]2+(NO3)2 ® [UO22+ (ТБФ)2 (NO3)-2]- + 6H2O.
Разделение редкоземельных элементов
Скандий. Отделение от других трёхвалентных элементов основано на том, что Sc способен образовывать комплекс с ионом F-. ScF3$ + 3KF ® K3[ScF6]3- (раствор). (La/Y)F3 + KF3 ¹. Церий. В основе отделения церия от других РЗЭ — способность обладать степенью окисления +4: Ce(OH)4$ + HCl ® (pH» 1,5) ® 2CeCl3 + Cl2# + 8H2O. Ce(OH)3$ + HCl ® CeCl3 + 3H2O. R(OH)3$ + HCl ® (pH = 6,5) ® RCl3 + 3H2O. Комплексообразование — один из способов отделения: церий, в отличие от других редкоземельных элементов, в степени окисления +3 способен образовывать комплексы с КЧ = 8 (растворы солей: оксолатов и карбонатов): Ce(C2O4)2$ + (NH4)C2O4 ® (NH4)[Ce+4(C2O4)]4-. Na2/R2/Ce2(C2O4)3$ + (NH4)C2O4 ¹. Европий. Отделение от других РЗЭ связано с его способностью образовывать труднорастворимый сульфат в двухвалентном состоянии: R2(SO4)3 — раствор. Eu2(SO4)3 + Zn (" восстановитель) ® (pH < 7) ® 2EuSO4$ + ZnSO4. Eu(OH)2 + H2SO4 " EuSO4 + 2H2O. R2SO4 растворим. Торий. От Ce3+ и R3+ (РЗ): Кислотно-основное: Th(OH)4$ + 4HCl ® (pH = 3) ® ThCl4 + 4H2O. R(OH)3$ + 3HCl ® (pH = 6,5) ® RCl3 + 3H2O. 2Ce(OH)3$ + 8HCl ® (pH = 1) ® 2CeCl3 + Cl2 + H2O. Комплексообразование (Th4+ — мощный комплексообразователь): ThCl4 + (NH4)2C2O4 ® (NH4)4[Th[C2O4)4] + 4NH4Cl RCl3 + 3(NH4)2C2O4 ® R2(C2O4)3$ + 3NH4Cl. От (UO2)2+: На образовании труднорастворимых фторидов: ThCl4 + 4KF ® ThF4$ + 4KCl UO2Cl2 + KF ® UO2F2 (раствор) + KCl. На комплексообразовании: ThCl4 + 4(NH4)2C2O4 ® (NH4)4[Th4+(C2O4)4]4- + 4NH4Cl. 2RCl3 + Na2C2O4 ® R2(C2O4)$ + NaCl. От U+6: ThCl4 + 4KF ® ThF4$ + 4KCl. UO2Cl2 + 2KF ® UO2F2 (раствор) ® 2KCl. Уран. UO2SO4 + 3Na2CO3 " Na4[UO2(CO3)3] + Na2SO4. Fe2(SO4) + 3Na2CO + 6H2O " 2Fe(OH)3$ + 3H2CO3 + 3NaSO4. 2RCl3 + 3Na2CO3 " R2(CO3)3$ + 6NaCl.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1719; Нарушение авторских прав?; Мы поможем в написании вашей работы!