
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика d-элементов VIБ-группы
|
|
|
|
 VIБ-группу составляют элементы (переходные металлы) — хром, молибден и вольфрам. Эти редкие металлы находятся в природе в небольшом количестве. Однако благодаря целому ряду полезных химических и физических свойств, широко применяются не только в машиностроении и химической технологии, но и в медицинской практике (сплав Сr—Со—Мо используется в хирургии и стоматологии, молибден и его сплавы применяются как детали рентгеновских трубок, из вольфрама изготовляют аноды рентгеновских трубок, сплавы вольфрама — основа экранов для зашиты от γ-лучей).
VIБ-группу составляют элементы (переходные металлы) — хром, молибден и вольфрам. Эти редкие металлы находятся в природе в небольшом количестве. Однако благодаря целому ряду полезных химических и физических свойств, широко применяются не только в машиностроении и химической технологии, но и в медицинской практике (сплав Сr—Со—Мо используется в хирургии и стоматологии, молибден и его сплавы применяются как детали рентгеновских трубок, из вольфрама изготовляют аноды рентгеновских трубок, сплавы вольфрама — основа экранов для зашиты от γ-лучей).
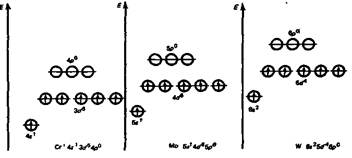
Конфигурация валентных электронов Сг и Мо — (n-1)d5ns1, W — 5d46s2. Сумма валентных электронов хрома, молибдена, вольфрама равна 6, что и определяет их положение в VIБ-группе. У Сr и Мо последний электронный слой занимают 13 электронов, у W — 12. Как у большинства d-элементов этот слой неустойчив. Поэтому валентность хрома, молибдена и вольфрама непостоянна. По этой же причине соединения металлов группы VIБ характеризуются набором степеней окисления от +2 до +6.
В группе d-элементов проявляется общая тенденция: с увеличением порядкового номера увеличивается устойчивость соединений с высшей степенью окисления. Самым сильным окислителем в состоянии Э6+ является хром. «Пограничный» Мо6+ проявляет слабые окислительные свойства. Молибде-нат-ион МоО42- восстанавливается лишь до Мо6О17 («молибденовая синь»), где часть атомов молибдена имеет степень окисления +5. Эта реакция используется в аналитической химии для фотометрических определений.
В низших валентных состояниях, следуя все той же тенденции, более сильные восстановительные свойства проявляет Сг2+. У ионов Мо2+ и W2+ увеличение энергии ионизации приводит к уменьшению восстановительных и металлических свойств.
|
|
|
Комплексные соединения данной группы элементов чаще всего имеют координационное число 6 и гибридизацию типа sр3d2, которая в пространстве описывается октаэдром.
Характерной особенностью соединений этой группы является склонность к полимеризации (конденсации) кислородных форм элементов VI группы. Это свойство усиливается при движении по группе сверху вниз. При этом образуются соединения типа М6О2412-, составленные из октаэдров МоO4 и WO4. Эти октаэдры образуют полимерные кристаллы. У оксида хрома (VI) способность к полимеризации проявляется, но слабо. Поэтому у оксидов молибдена и вольфрама степень полимеризации выше.
По строению электронной оболочки атомов с незаполненной d-орбиталью, совокупности физических и химических свойств, по склонности к образованию электроположительных ионов и координационных соединений элементы VI группы относятся к переходным металлам.
Химические свойства соединений хрома. Большинство соединений хрома имеет яркую окраску самых разных цветов. Название происходит от греч. хромоc — цвет, окраска.
Соединения трехвалентного хрома (в отличие от соединений молибдена, а для вольфрама степень окисления +3 вообще не характерна) химически инертны.
В природе хром находится в трехвалентном (шпинель — двойной оксид МnСrO4 — магнохромит) и шестивалентном состоянии (РbСrO4 — крокоит). Образует оксиды основного, амфотерного и кислотного характера.
Оксид хрома (II) СrО — кристаллы красного (красно-коричневого) цвета или черный пирофорный порошок, нерастворимый в воде. Соответствует гидроксиду Сr(ОН)2. Гидроксид желтого (влажный) или коричневого цвета. При прокаливании на воздухе превращается в Сr2О3 (зеленого цвета):
2Сr(ОН)2 + 0,5О2 = Сr2O3 + 2Н2О
Катион Сr2+ — бесцветен, его безводные соли белого, а водные — синего цвета. Соли двухвалентного хрома являются энергичными восстановителями. Водный раствор хлорида хрома (II) используется в газовом анализе для количественного поглощения кислорода:
|
|
|
2СrСl2 + 2НgО + 3Н2O + 0,5О2 = 2НgСl2 + 2Сr(ОН)3↓
(грязно-зеленый осадок)
Гидроксид хрома (III) обладает амфотерными свойствами. Легко переходит в коллоидное состояние. Растворяясь в кислотах и щелочах, образует аква- или гидроксокомплексы:
Сr(ОН)3 + 3Н3О+ = [Сr(Н2О)6]3+ (сине-фиолетовый раствор)
Сr(ОН)3 + 3ОН- = [Сr(ОН)6]3- (изумрудно-зеленый раствор)
Соединения трехвалентного хрома, как и двухвалентного, проявляют восстановительные свойства:
Сr2(SO4)з+КСlО3 + 10КОН = 2К2СrO4 + 3К2SО4 + КСl + 5Н2О
Соединения хрома (VI), как правило, кислородсодержащие комплексы хрома. Оксид шестивалентного хрома соответствует хромовым кислотам.
Хромовые кислоты образуются при растворении в воде СrО3. Это сильно токсичные растворы желтого, оранжевого и красного цвета, обладающие окислительными свойствами. СrО3 образует полихромовые кислоты состава Н2СrnО(3n+1): nCrО3 + Н2О → Н2СrnО(3n+1). Таких соединений может быть несколько: Н2СrО4, Н2Сr2О7, Н2Сr3О10, Н2Сr4О13. Цвета растворов меняются от желтого до красного. Окраска зависит от содержания СrО3 в растворе, концентрация СrО3 влияет на образование полихромовых кислот разной степени полимеризации (от моно- до полихромовой кислоты).
Окислительные свойства дихромовой кислоты лежат в основе объемного оксидиметрического метода количественного анализа — хроматометрии. В методе применяется раствор сильного окислителя — дихромата калия.
Государственная фармакопея рекомендует для определения подлинности раствора пероксида водорода использовать реакцию
К2Сr2О7 + 4Н2О2 + Н2SО4 = К2SО4 + 2Н2СrО6 + 3Н2О
При этом образуется дипероксохромовая (Н2СrО6) или пероксохромовая (НСrО5) кислота — соединение синего цвета. Синяя окраска и подтверждает подлинность препарата Н2О2.
Хроматометрию применяют также в санитарно-гигиенической практике для анализа промышленных и сточных вод. В ходе анализа определяется «окисляемость воды», которая показывает общее содержание соединений восстановительного характера.
СrО3 обладает прижигающим действием. Это свойство используется в медицине. Тем не менее, необходимо помнить, что соли хрома (III) и хрома(VI) токсичны для человека. Смертельная доза К2Сг2О7 для взрослого человека составляет всего 0,3 г.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1483; Нарушение авторских прав?; Мы поможем в написании вашей работы!