
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анодная защита
|
|
|
|
Применяется для защиты аппаратуры, изготовленной из нержавеющих и углеродистых сталей, титана, циркония и т.д. при работе в сильно агрессивных средах. Ее используют также часто с целью снижения загрязнений агрессивной среды продуктами коррозии.
Анодная защита применяется в тех случаях, когда металл или сплав способны перейти в пассивное состояние. Анодная защита осуществляется присоединением защищаемого изделия к положительному полюсу внешнего источника постоянного тока или к Ме с более положительным потенциалом. Катоды должны иметь высокую устойчивость в коррозионной среде. Выбор материала катода определяется характером среды. Применяют: хромоникелевые стали (для кислот), кремнистый чугун (для растворов неорганических солей, серной кислоты), никель (для щелочных сред).
Скорость коррозии при анодной защите может быть снижена до минимальной величины, но никогда не уменьшается до нуля, как в катодной защите.
5.6 Ингибиторы
Ингибиторами (отрицательными катализаторами) называют вещества, которые вызывают уменьшение или полное подавление процессов коррозии металлов.
Основные пути уменьшения скорости коррозии:
а). торможение анодной реакции - анодные ингибиторы;
б). торможение катодной реакции - катодные ингибиторы;
в). торможение обоих реакций - смешанные ингибиторы;
г). Уменьшение окислительно-восстановительного потенциала системы - катодные.
Так как коррозия протекает в различных средах, ингибиторы могут быть также условно разделены на три основные группы:
1) ингибиторы нейтральной среды (рН=7);
2) ингибиторы кислотной коррозии металлов (рН<7);
3) ингибиторы атмосферной коррозии.
В настоящее время известно около 2000 различных неорганических и органических веществ, обладающих ингибирующими свойствами
|
|
|
Механизм защитного действия сложен, но, в первую очередь, он связан о адсорбцией ингибиторов на металлических поверхностям.
НЕЙТРАЛЬНЫЕ СРЕДЫ.
1). NO2-анодный ингибитор, обладающий сильными окислительными свойствами:
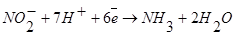
Такой процесс способствует образованию на поверхности железа защитной оксидной плёнки. Защитное действие нитритов резко ухудшается при наличии в растворе ионов Cl,PO 43,, SO32-
2). K2ClO4 и K2Cr2O7 – ингибиторы смешанного действия, помимо окисления, они способствуют образованию на стали защитной пленки из гидроксидов хрома и железа.
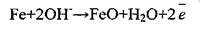
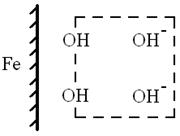
механизм пассивации железа ионом ОН рис.10
рис.10
3). NaOH, Na3PO4, Ca2HPO4, Ca2CO3 – образуют на поверхности железа труднорастворимые соединения.
Торможение катодной реакции можно осуществлять деаэрацией - практически полное удаление из Н2О растворимого О2 (в энергетических установках).
Кислые среды.
Используются только органические вещества. В судостроении
применяется уротропин при травлении сталей. При травлении сталей в кислоте растворяются только продукты коррозии (окалина, ржавчина), но не затрачивается сам металл.
Органические ингибиторы образуют на поверхности металлов фазовые или адсорбционные пленки, затрудняющие доступ кислорода.
О2+2Н2О+4e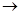 4ОН
4ОН
Введение в коррозионную среду солей Zn или Са приводит к образованию ионов ОН малорастворимых гидроксидов.
малорастворимых гидроксидов.
Примерно такой же эффект используется для защиты трубопроводов, и теплообменной аппаратуры, где регулируется содержание растворенного в воде углекислого газа, таким образом, что равновесие в реакции смещено в сторону нерастворенного СаСО3: Са(НСО3)2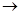 СаСО3
СаСО3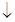 +СО2+Н2О
+СО2+Н2О
Этот осадок на металлических поверхностях замедляет катодный процесс.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 536; Нарушение авторских прав?; Мы поможем в написании вашей работы!