
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Чем меньше DG (больше Aпол ), тем полнее протекает процесс
|
|
|
|

▼D rG < 0 – самопроизвольный процесс – реакция в прямом направлении;
▼D rG > 0 - самопроизвольный процесс – реакция в обратном направлении;
▼D rG = 0 – система в равновесном состоянии.
Направление протекания процесса зависит от соотношения энтальпийного ∆ rН и энтропийного Т ∆ rS факторов реакции.
D rG = D rH - Т Δ r S
| знак | Принципиальная возможность и условия протекания прямой реакции | |||
| ∆ rН | ∆ rS | Dr G | ||
| - | + | - | Возможна при любой температуре | |
| + | - | + | Невозможна. Возможна в обратном направлении | |
| - | - | - + | Возможна при низких температурах | |
| + | + | + - | Возможна при высоких температурах |

∆ fG (простых веществ) = 0
∆ fG 0 - стандартная энергия Гиббса образования вещества (вещества находятся в стандартном состоянии)
∆ fG 0298, - табулирована [кДж/моль ]
Dr G рассчитывают:
● 1-й способ по закону Гесса:
Δ rGT = ∑ν i Δ fGT,i продуктов - ∑ν j Δ fGT,j исх веществ
Δ rG0298 =∑ν i Δ fG0298,i продуктов-∑ν j Δ fG 0298,j исх веществ
● 2-й способ по уравнению:
Δ rGT = ∆ rHT - T ∆ rST
Δ rG0298 = ∆ rH0298 - T ∆ rS0298
● 3-й способ изотерма Вант Гоффа, 1886г. (связь между Δ rGT и ∆ rG0T): для реакции a Aг + b Bг + d Dк = e Eг + f Fг
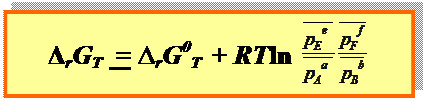 |
 – относительные парциальные давления газообразных веществ,
– относительные парциальные давления газообразных веществ,  = p/100 кПа.
= p/100 кПа.
∆ rG0Т = ∆ rH0Т - T ∆ rS0Т =
= ∆ rH 0298 +  ∆ rС0pdT -Т ∆ rS0 298- Т
∆ rС0pdT -Т ∆ rS0 298- Т 
 dT
dT
Для приближения ∆ rС0p =0:
∆ rН 0 Т = ∆ rН 0298
∆ rS0T = ∆ rS0 298
∆ rG0Т = ∆ rH0298 - T ∆ rS0298 - для ваших расчетов!
Задача. Определите возможности самопроизвольного протекания реакции
С(к) + СО2(г) = 2СО(г)
при 298К и 1000К и стандартных состояниях всех компонентов (∆ rН 0 Т и ∆ rS0T - не зависят от температуры).
|
|
|
Решение. Возможность самопроизвольного протекания реакции определяется: ∆ rG0T< 0
∆ rG0Т = ∆ rH0Т - T ∆ rS0Т = ∆ rH0298 - T ∆ rS0298
∆ rG0298 = 172,5 – 298 . 175,66 . 10-3 = 120,15 кДж > 0 - в прямом направлении невозможна (энтальпийный фактор не способствует самопроизвольному протеканию прямой реакции).
∆ rG01000 = 172,5 – 1000 . 175,66 . 10-3 = -3,16 кДж < 0 - в прямом направлении возможна (энтропийный фактор способствует самопроизвольному протеканию прямой реакции).
Задача. При каком соотношении парциальных давлений газообразных компонентов реакции и 298К
С(к) + СО2(г) = 2СО(г)
возможно ее протекание в прямом направлении?
Решение. Возможность самопроизвольного протекания реакции: Δ rG298 <0
По уравнению изотермы Вант-Гоффа:
Δ rG298 =[ ∆rG0298 + RT ln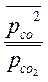 ] < 0.
] < 0.
120,15 + 8,31.10-3.298 ln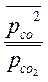 <0
<0
ln 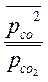 < -48,5 Þ
< -48,5 Þ 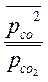 <10-21
<10-21
Задача. Определить температурную область самопроизвольного протекания реакции
Ск + СО2(г) = 2СО(г)
при стандартных состояниях компонентов.
Решение. Реакция протекает самопроизвольно при стандартных состояниях компонентов, если:
∆ rG0Т =∆ rH 0298+ ∆ rС0pdT+Т ∆ rS0 298+ Т
∆ rС0pdT+Т ∆ rS0 298+ Т  ∆ rС0p/T) dT <0 – опускаем!
∆ rС0p/T) dT <0 – опускаем!
Если ∆ rH0 и ∆ rS0 не зависят от температуры:
∆ rG0Т = ∆ rH0298 - T ∆ rS0298 < 0.
(172,5 – Т .175,66.10-3) < 0
Т > 982 К
Из справочных данных:
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 232; Нарушение авторских прав?; Мы поможем в написании вашей работы!