
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Добування оксигену
|
|
|
|
1) у промисловості – ректифікація рідкого повітря електролізом води:
 Н2О Н+ + ОН-
Н2О Н+ + ОН-
К(-): 2 Н2О + 2 ē = Н2 + 2 ОН-
А(+): 2 Н2О – 4 ē = О2 + 4 Н+
2) в лабораторії:
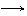 2KMnO4 K2MnO4 + MnO2 + O2
2KMnO4 K2MnO4 + MnO2 + O2
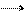 2HgO 2Hg + O2
2HgO 2Hg + O2
 2H2O2 2H2O + O2
2H2O2 2H2O + O2
2 KMnO4 + 5 H2O2 + 3 H2SO4 = 2 MnSO4 + 5 O2 + K2SO4 + 8 H2O
3) в природі – при фотосинтезі:
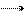 6 CO2 + 6 H2O + світло C6H12O6 + 6 O2
6 CO2 + 6 H2O + світло C6H12O6 + 6 O2
4) розклад нітратів:
[до Mg] – MeNO2 + O2
MeNO3 – [Mg-Cu] – MeO + NO2 + O2
[Cu] – Me + NO2 + O2
Оксиген виявляє окислювальні властивості. Він реагує з:
1) металами:
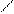 4 Li + O2 = 2 Li2O, 2 Na + O2 = Na2O2, K + 2 O2 = K2O4, Au, Pt + O2 = не реагує
4 Li + O2 = 2 Li2O, 2 Na + O2 = Na2O2, K + 2 O2 = K2O4, Au, Pt + O2 = не реагує
2) неметалами:
S + O2 = SO2, 4 P + 5 O2 = 2 P2O5
3) горіння складних речовин:
CH4 + 2O2 = 2CO2 + 2H2O, C2H5OH + 3 O2 = 2CO2 + 3H2O
4) доокиснення:
2NO + O2 = 2 NO2, 4NO2 + H2O + O2 = 4 HNO3, 2 CO + O2 = 2 CO2
Сульфур – 2-й елемент VI групи

 S
S
Октаедрична Аморфна
(пластична s) (ромбічна)
α - s моноклінна
(призматична)
β - s
у парах S знаходиться у вигляді:
S8 – S6 – S4 – S2
Добування:
1. Метод Фраша – виплавки S із гірських порід
 FeS2 = FeS + S
FeS2 = FeS + S
пар
Хімічні методи:
2 H2S + 3 O2 = 2 SO2 + 2 H2O
4 C + CaSO4 = 4 CO + CaS
2 KMnO4 + 5 H2S + 3 H2SO4 = 2 MnSO4 + 5S + K2SO4 + 8 H2O
Сульфур реагує:
1) з металами:
Fe + S = FeS, Hg + S = HgS
2) з неметалами:
H2 + S = H2S, C + 2S = CS2, S + O2 = SO2, 2 P + 3 S = P2S3
3) з лугами:
S + 6 KOH = 2 K2S + K2SO3 + 3 H2O
4) з кислотами:
S + 4 HNO3(k) = SO2 + 4 NO2 + 2 H2O
3. Озон. Пероксид водню О


 Озон – О3 О О
Озон – О3 О О
Газ із приємним запахом. Дуже сильний окисник.
2 Ag + O3 = Ag2O + O2
PbS + 2 O3 = PbSO4 + O2
2 KI + O3 + H2O = 2 KOH + I2 + O2
|
 |  |  | |||
для відбілювання у харчовій для дезінфекції
тканин промисловості приміщень
Пероксид водню – Н2О2-1
Н – О – О – Н – це рідина, 3-5 % розчин якої використовують в медицині як дезінфікуючий засіб.
Отримання: 1) BaO2 + H2SO4 = Ва SO4 + H2O2
2) BaO2 + CO2 + H2O = BaCO3 + H2O2
В окисно-відновних реакціях H2O2 виступає і окисником, і відновником.
+3 -1 +6 -2
|
|
|
2 KCrO2 + 3 H2O2 + 2 KOH = 2 K2CrO4 + 4 H2O



6ē 2ē окисник
+6 -1 +3 0
 K2Cr2O7 + 3 H2O2 + 4 H2SO4 = Cr2(SO4)3 + 2 O2 + K2SO4 + 7 H2O
K2Cr2O7 + 3 H2O2 + 4 H2SO4 = Cr2(SO4)3 + 2 O2 + K2SO4 + 7 H2O

6ē 2ē відновник
4. Важливіші сполуки р-елементів VI групи та їх застосування
| Формула сполуки | Назва | Застосування |
| H2SO4 CaSO4 * 2H2O MgSO4 * 7H2O CuSO4 * 5H2О Na2S2O3 * 5H2O | Сульфатна кислота Гіпс Магній сульфат Мідний купорос Тіосульфат натрію | У хімічній промисловості, для отри-мання мінеральних добрив, як каталізатор В`яжучий матеріал в будівництві, у медицині У медицині Як отрутохімікат У фотографії, у медицині |
5. Оксигеновмісні сполуки сульфуру, H2SO4

 SO2 H2SO3 (NaSO3 NaHSO3)
SO2 H2SO3 (NaSO3 NaHSO3)
 S
S
 SO3 H2SO4 (KSO4 KHSO4)
SO3 H2SO4 (KSO4 KHSO4)
H2SO4 отримують контактним методом, який включає три стадії:
I 4 FeS2 + 11 O2 =2 Fe2O3 + 8 SO2
II 2 SO2 + O2 = 2 SO3
III SO3 + H2O = H2SO4
Особливості H2SO4(к) при взаємодiї з металами
+6 0 +2 +4
2 H2SO4(к) + Cu = CuSO4 + SO2 + 2 H2O
oкисник
5 H2SO4(к) + 4 Zn = 4 ZnSO4 + H2S + 5 H2O
4 H2SO4(к) + 3 Ca = 3 CaSO4 + S + 4 H2O
 H2SO4(к) + Fe, Al, Cr = не реагує
H2SO4(к) + Fe, Al, Cr = не реагує
Питання для самоконтролю
1. Як і чому змінюються металічні властивості р-елементів VI групи від оксигену до полонію?
2. Назвіть сфери застосування сірки та її важливих сполук.
3. Що таке сірчаний цвіт?
4. Напишіть якісні реакції на сульфат, сульфіт та сульфід-йони.
5. У 300 мл Н2О розчинили 3,5 V H2S (у.н.). Визначте масову частку H2S в розчині.
6. Назвіть технічні матеріали, в яких міститься сульфур.
7. Закінчить рівняння реакцій, складіть схеми електронного балансу:
SO2 + SCO2 =
H2S + H2SO3 =
FeS + O2 =
NaOH + S =
S + H2SO4(k) =
KMnO4+ Na2S + H2SO4 =
K2Cr2O7 + H2S +H2O =
Елементи V групи періодичної системи Д.І.Менделєєва
План
1. Загальна характеристика р-елементів V групи.
2. Нітроген. Аміак.
3. Нітратна кислота. Азотні добрива.
4. Фосфор. Ортофосфатна кислота.
5. Важливіші сполуки р-елементів та їх застосування.
Рекомендована література:
Основна: [1, 2, 3, 4, 5]; Додаткова: [1, 3, 5, 6, 7]
Міні-лексікон: нітроген, нітратна кислота, нітрати, солі амонію
1. Загальна характеристика р-елементів V групи
|
|
|
| Елемент | Будова останнього електронного шару | Ступінь окиснення |
| 7 N 15 P 33 As 51 Sb 83 Bi | 1s22s22p3 ....3s23p3 ....4s24p3 ....5s25p3 ....6s26p3 | -3, -2, -1, 0, +1,+5 -3, 0, +3, +5 -3, 0, +3, +5 -3, 0, +3, +5 -3, 0, +3, +5 |
- всі вони р-елементи
- з оксигеном утворюють сполуки: Е2О3, Е2О5
- з гідрогеном - ЕН3
- збільшується tok від 195 у N до +1550 оС у Bi
- у N відсутні d-орбіталі, тому максимальна валентність N = IV
- до завершення електронного шару всім елементам не вистачає 3ē, і тому вони
виявляють ступінь окиснення 3.
2. Нітроген. Аміак
N – нітроген (той, що утворює селітру).
N2 - газ без кольору і запаху, досить інертний в хімічному відношенні N ≡ N.
Він реагує з:
1) металами: N2 + 3 Mg = Mg3N2
2) неметалами: 2 B + N2 = 2 BN, N2 + 3H2 = 2 NH3, N + O2 = 2 NO, C2 + N2 = C2N2 (CN)2
Нітроген утворює декілька оксидів: N2O, NO, N2O3, N2O5
NН3 – аміак – газ з різким запахом, добре розчиняється у воді
NH3 + H2O= NH4OH, NH3 + HCl = NH4Cl, 2 NH3 + H2SO4 = (NH4)2SO4
|
|
 | ||
 |
Застосування NH3
- як холодоагент
- для отримання солей амонію
- синтез сечовини і нашатирного спирту
- синтез НNO3
3. Нітратна кислота. Азотні добрива
НNO3 – нітратна кислота, досить сильний електроліт і є окисником.
Cu + 4HNO3(k) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(p) = 3Cu(NO3)2 + 2NO + 4H2O
 4Ca + HNO3(p) = 4Ca(NO3)2 + NH4NO3 + 3H2O
4Ca + HNO3(p) = 4Ca(NO3)2 + NH4NO3 + 3H2O
 Fe, Cr, Al + HNO3(k) = не реагує
Fe, Cr, Al + HNO3(k) = не реагує
Отримання HNO3
1) каталітичне окиснення аміаку: NH3 – NO – NO2 – HNO3
2) електродуговий метод: N2 – NO – NO2 – HNO3
3) в лабораторії: KNO3 + H2SO4(k) = KHSO4 + HNO3
Азотні добрива
Нітрати-селітри: KNO3, NaNO3, Ca(NO3)2, NH4NO3
Cолі амонію: NH4Cl, (NH4)2SO4, (NH4)3PO4, NH4H2PO4, (NH4)2HPO4
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 629; Нарушение авторских прав?; Мы поможем в написании вашей работы!