
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Додаткова. 1. Романова Н.В. Загальна та неорганічна хімія
Основна
1. Романова Н.В. Загальна та неорганічна хімія. – К.: Перун, 1998. – 497 с.
2. Зубович И.А. Неорганическая химия. – М.: Высш. школа, 1989. – 430 с.
3. Полумбрик О.М., Карнаухов О.І., Федоренко П.В. Окисно-відновні процеси: Навч. Посіб. – К., НУХТ, 2002. – 340 с.
4. Красовський О.М., Буряк В.Ю., Федоренко П.В. Хімія та методи дослідження сировини та матеріалів: Навч. посіб. – Чернігів, 2003. – 184 с.
5. Малиновський В.В., Нагорний П.Г. Неорганічна хімія: Навч. посіб. – Чернігів, 2003. – 183 с.
1. Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. – К., 1996. – 255 с.
2. Федоренко П.В. Хімія та методи дослідження сировини та матеріалів. Опорний конспект лекцій. 1 ч. – К., 2003. – 52 с.
3. Ісаєнко Н.І., Федоренко П.В. Хімія та методи дослідження сировини та матеріалів. Опорний конспект лекцій. Розділ „Аналітична хімія”. – К., 2002. – 63 с.
4. Полумбрик О.М., Федоренко П.В. Методичні вказівки до виконання лабораторних робіт. – К., УДУХТ, 1999. – 95 с.
5. Полумбрик О.М., Федоренко П.В. Методичний посібник з хімії. – К., УДУХТ, 1996. – 40 с.
6. Федоренко П.В. Методичні вказівки до вивчення теми „Основні класи неорганічних сполук”. – К., УДУХТ, 1996. – 30 с.
7. Федоренко П.В., Ісаєнко Н.І. Методичні вказівки до самостійної роботи, розділ „Координаційні сполуки”. – К., 2002. – 55 с.
....
(Змістовний модуль 3)
ПН.21: Хімія конструкційних та ядерно-паливних матеріалів в енергетиці
Тема 15. Хімія конструкційних та ядерно-паливних матеріалів в енергетиці
План
-
-
Змагання видів енергії.
Джерелом енергії на нашій планеті є Сонце, вода, горючі корисні копалини, тепло земної кори, вітер. В середині ХХ ст. ці природні джерела доповнились розщепленням атомних ядер. Хімічна енергія горючих матеріалів задовольнятиме потреби в енергії ще дуже довго. Вода не впливає сут-тєво на світовий енергетичний баланс. Тим не менш вона є ідеальним джерелом дешевої енергії для різних великих виробництв, наприклад, для добування алюмінію, сталі, карбідів металів, їдко-го натру, рідких металів і т.д.
Родоначальником всіх відомих нам видів енергії, включаючи і ядерну, є Сонце. Щосекундно воно випромінює в світовий простір 2,86 х 1033 кВт. Земля одержує лише 2 х 107 цього потоку енергії, але навіть такою крихітною долею енергії небесне світило забезпечує всі різноманітні форми життя на планеті. За 3 доби Земля одержує від Сонця таку кількість енергії, яка могла б звільнитись при спалюванні всіх запасів вугілля, газу, нафти і деревини. Звідси стає зрозуміло, що Сонце могло б задовольнити любі мислимі потреби людей в енергії, якби тільки знати, як її реалі-зувати. Розроблені в наш час геліоустановки відносяться до області «малої енергетики». Для хіміків і фізиків безсумнівний інтерес полягає в тому, що деякі сонячні печі можна використати для вивчення поведінки різних речовин при температурі 3800оС. Вони мають ту перевагу, що гаряча зона має більшу протяжність і що можна одержати розплав максимальної хімічної чистоти.
Трудність використання сонячної енергії полягає у виборі перетворювача енергії. В наш час використовується напівпровідникові фотоелементи із кремнієвих пластинок, дія яких основана на фотоефекті. Ефективність перетворення сонячної енергії в електричну складає поки всього 15%, але є підстави, що її можна буде підвищити до 30-40%. Суми капіталовкладень на 1Квт електро-енергії, яку виробляють сонячні електростанції, все ще в 1000 разів більші, ніж звичайні гідро-електростанції. З часом навіть саму дешеву можливість використання сонячної енергії можна буде реалізувати тільки тоді, коли оволодіємо процесами фотосинтезу.
Надзвичайним енергоносієм є водень. Із усіх речовин він має найбільшу густину енергії, яка дорівнює 33 кВт (кг), густина енергії вуглецю – 9,1кВт (кг), він може прямим шляхом виробляти електричну енергію в паливних елементах. В зв’язку з цим уже обговорюються проекти магіст-ральних водневих ліній, як одного з варіантів ліній електропередач майбутнього.
Запаси тепла в десятикілометровому шарі земної кори перевищують теплотворну здатність всіх горючих речовин нашої планети в 5 тис.раз. Лише в Ісландії і Росії використовуються геотермаль-ні джерела, але лише для обігрівання. Але їх можна застосовувати також для виробництва електро-енергії, а також на дослідних установках хімічних виробництв.
Основна тенденція в зміні структури енергетичного балансу – це, без сумніву, все більше вико-ристання атомної енергії. Всього 1 кг U – 235 виділяє при розщепленні 24 млн. кВт, що відповідає теплотворній здатності майже 3 тис.т. кам’яного вугілля, тобто 1кг урану дає майже в 3 млн.раз більше енергії, ніж 1кг кам’яного вугілля і в 7 млн. раз більше, ніж 1кг бурого вугілля. Уже після 1980 р. ядерне паливо забезпечує суттєву долю загальної потреби в електроенергії, і перш за все в електроенергії. В майбутньому атомні електростанції будуть виробляти 90% електроенергії. Роз-виток ядерної енергетики вплине позитивно на розвиткові хімічної промисловості.Уже в 80-ті роки ХХ ст. завдяки помірній вартості енергії атомних електростанцій значно розширився цілий ряд енергоємних електрохімічних виробництв, особливо електролітичних процесів добування металів і основних хімічних продуктів. Крім того, тепло ядерних реакторів теж може бути утилізоване на потреби хімічної промисловості.
В протилежність карбоновмісним носіям енергії, які є дуже важливою сировиною для хімічної промисловості, уран можна використати лише для виробництва енергії. Оскільки цей елемент легко розщеплюється в звичайних реакторах а його запаси на суші доступні, то приблизно через 100 років вони будуть вичерпані. Тому з 80-тих років здійснюється розщеплення швидкими нейт-ронами U – 238, Тh – 232. Ці елементи стабільні, але в реакторах-розмножувачах вони перетворю-ються в U – 233 і Рu -239 з виділенням колосальної енергії. Виявлена цікава перспектива розши-реного виробництва ядерного палива, що дозволить підняти його корисні запаси в 120 раз (без врахування урану, що є в морській воді). Таким чином, людство зможе забезпечити свої потреби в енергії за рахунок атомної енергії на протязі декількох тисячоліть.
А якщо повернутись до геотермальних вод, то їх загальний світовий запас складає 700 млн.м3. Якщо теплову енергію всього лише 10% цієї кількості перетворити в електроенергію, то її виста-чить на 4 млрд. років. На планеті вже є геотермальні електростанції і будуються нові. Їх потуж-ність до кінця 1980 р. досягла 3800 МВт.
Розумна господарська політика країн у відношенні до енергії і палива вимагає включити одно-сторонність при використанні енергоресурсів. Необхідно планувати раціональну розробку всіх джерел енергії, що є в країні. Це забезпечить стабільне і ефективне забезпечення енергією всіх галузей матеріального виробництва не тільки в наш час, а й у віддаленому майбутньому.
Слід пам’ятати, що хімічна промисловість – це єдність хімії, технології, енергетики, апарато-будівництва, матеріаловедення, науки управління. Запровадження любого хімічного процесу, який забезпечить навіть 100 % вихід продукту і високий ККД, не можна здійснити без необхідної апара-тури, без видобутку необхідної сировини, підводу енергії, без утилізації відходів. Кожна із стадій виробництва важлива, і всі разом вони складають нерозривне ціле.
Реактор водяного охолодження чуються речовиною, яка сповільнює їх рух. У більшості сучасних реакторів вода використовується як для сповільнення руху нейтронів, так і для охолодження реактора. |
Уран-238 в процесі випромінювання поступово і послідовно перетворюється в 14 ізотопів різних хімічних елементів доки не стабілізується у вигляді Pb206. При кожному акті розпаду вивільняється енергія, яка і виділяється у вигляді радіоактивного випромінювання чи радіоактивних частинок. Як ми вже знаємо, ісують α-, β-частинки і γ-випромінювання. Досить спрощено можна уявити, що α-випромінювання – це процес вивільнення ядром атома двох протонів і двох нейтронів. Оскільки це досить важкі частинки, вони легко затримуються навіть листком паперу; β-випромінювання – це процес вивільнення електрона, а γ-випромінювання – це викид кванта енергії. Оскільки енергія поширюється як електромагнітна хвиля, вона легко пронизує організм людини.
α β- β- α
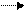
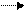
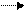
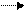 23892U 4,56 * 109 23490Th 24 дні 23491Pa 6,74 23492U 2,48 * 105
23892U 4,56 * 109 23490Th 24 дні 23491Pa 6,74 23492U 2,48 * 105
радіо- років днів років
активний
α α α α








 23090Th 8 * 104 22688Ra 1617 22286Rn 3,8 21884Po 3
23090Th 8 * 104 22688Ra 1617 22286Rn 3,8 21884Po 3
років років днів хвил.
β- β-




 21482Pb 27 21483Bi 20 21081Tl
21482Pb 27 21483Bi 20 21081Tl

 хвил. хвил.
хвил. хвил.
β- 1,32 хвил.
α β-



 21484Po 10-4 21082Pb 23
21484Po 10-4 21082Pb 23
сек. роки
α
 21083Bi 5 20681Tl
21083Bi 5 20681Tl

 днів
днів
β- β- 4,2 хвил.
α
 21084Po 138 20682Pb
21084Po 138 20682Pb
днів стабільний
(нерадіоактивний)
ХІМІЧНІ ВЛАСТИВОСТІ УРАНУ ТА ЙОГО СПОЛУК
Д.І.Менделеєв розташував уран в самому кінці своєї періодичної системи в групі хрому, моліб-дену та вольфраму, виходячи з їх хімічних властивостей. В цілому ряді сполук вищої валентності уран виявляє харатерні риси аналогу хрому і особливо молібдену та вольфраму.Але дослідження атомного спектру пари урану виявили, що в основному стані він має електронну структуру 5f36d7s2, що свідчить про належність урану не до VI групи, а до групи важких актиноїдних елементів, аналогів групи лантаноїдів. Складність хімічних властивостей урану визначається близкістю енергетичних рівнів підгруп 5f і 6d електронної оболонки, взаємне розташування яких залежить від складу сполук. Таким чином, двоїстість природи урану, що спостерігається, спричинена близкістю енергій електро-нів 5f і 6d, що робить можливим перехід 5f-електронів на підрівень 6d в процесах хімічної взаємодії елементів.
Складність хімічної поведінки характерна не тільки для урану, але і для інших представників групи 5f-елементів. Так, вченими було відкрито семивалентний стан нептунію, плутонію, америцію і двох- та одно-валентного станів кюрію і менделеєвію.
Валентні стани урану
Добре відомі тверді сполуки урану, в яких ступінь окиснення урану дорівнює +2, +3, +4, +5 і +6. Іонні радіуси підвищуються із зменшенням валентного стану урану: 0,79 Ǻ для U (VI), 1,05 Ǻ для U (ІV), 1,2 Ǻ для U (ІІІ). Атомний радіус металічного урану складає 1,485 Ǻ (для γ-фази з екстраполя-цією до нормальної температури).
Завдяки низькому окиснювальному потенціалу урану (ІV) і урану (VI), можна легко отримати його сполуки в різних валентних станах. Полівалентність урану широко використовують в технології в процесах очищення урану від деяких домішок і виділення його в чистому вигляді.
Звичайні солі уранілу і їх розчини забарвлені в жовтий колір. Деякі сполуки шостивалентного урану білі або майже білі (гексафторид і ураніл-фторид). Солі урану (ІV) та їх розчини мають зелене забарвлення з різними відтінками. Солі урану (ІІІ) в твердому стані олівково-зелені, червоно-корич-неві або чорні в залежності від розмірів кристалів, в розчинах – пурпурно-червоні.
Хімія сполук урану досить складна, особливо в водних розчинах. З чотирьох можливих окислю-вально-відновлюваних станів для водних розчинів урану характерні лише два - (ІV) і (VI), що від-повідають іонам U4+ і UО22+. Лише в спеціальних умовах можливо отримання розчинів, які вміщують іони U3+. Досить нестійкий п”ятивалентний стан урану представляє собою лише проміжний стан в багатьох окисно-відновних реакціях за участю урану (ІV) і урану (VI). Йон п”ятивалентного урану
UО2+ відносно стійкий у вузькому діапазоні кислотності при рН біля 2, де він повільно диспропор-ціонує на U4+ і UО22+. В більш кислих розчинах реакція диспропорціонування проходить дуже швидко. Розчини урану (ІV) достатньо стійкі на повітрі у кислих розчинах, особливо при низьких значеннях рН середовища. Але цілий ряд звичайних окиснювачів легко переводить уран (ІV) в уран (VI). Нижче наведені потенціали різних ступенів окиснення урану (в кислому середовищі):
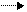
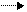
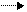
 U0 1,80 В U3+ +0,63В U4+ -0,58В UО2+ -0,06В UО22+.
U0 1,80 В U3+ +0,63В U4+ -0,58В UО2+ -0,06В UО22+.
Найбільш стійкий стан урану в водних розчинах – шестивалентний, при цьому стабілізація високого позитивного заряду урану відбувається внаслідок утворення іону уранілу UО22+.
Найважливіші хімічні сполуки урану
Висока хімічна активність урану, різновидність валентних форм і схильність до косплексоутво-рення обумовлюють існування різних хімічних сполук урану як практично з усіма неметалами, так і з багатьма металами (інтерметаліди). Широко представлені сполуки урану з кисневміщуючими кис-лотними радикалами. Найважливіші бінарні сполуки урану, що відіграють значну роль в технології урану – оксиди, нітріди, карбіди, гідріди і галогеніди, особливо фториди. Найбільш часто використо-вують такі солі уранілу, а також урану (ІV): сульфати, нітрати, хлориди, фториди, карбонати, фосфа-ти, ацетати, перхлорати. Солі уранілу, як правило, відрізняються високою розчинністю у водних (і в багатьох органічних) середовищах. Більшість солей уранілу і урану (ІV) у водних розчинах гідрато-вано.
Розчинність UO2SO4 * 3H2O у воді складає 20,5 г/100 г H2O (при 15 оС); UO2(NO3)2 * 6H2O - 170 г/100 г води H2O (при 0 оС); UO2(СООСН3)2 * 2Н2О – 9,2 г/100 г H2O при (при 17 оС); UO2F2 * 2H2O -
65 г/100 г води (при 25 оС). Важливіші важкорозчинені солі урану – диуранат амонію, уранати луж-них і лужно-земельних елементів, фосфати уранілу типу MeUO2PO4, тетрафторид UF4, фосфат урану (ІV), уранованадати і ін.
Комплексоутворення і гідроліз
Всі позитивно заряджені іони в водних розчинах у більшій чи меншій мірі здатні до асоціації з молекулами води (гідратація і гідроліз); більша частка цих іонів може асоціювати і з іншими ліган-дами (комплексоутворення). Ступінь такої асоціації визначається головним чином електронною структурою катіону. Внаслідок складної електронної конфігурації уран відноситься до числа еле-ментів, що дуже схильні до комплексоутворення. Відомо багато комплексних сполук як чотирьох- так і шестивалентного урану. Особливо багато комплексів ураніл-іону з неорганічними і органічними лігандами.
Найвищий ступінь комплексоутворення, гідратації і гідролізу характерний для невеликих за роз-міром і високо заряджених іонів, наприклад для U4+. За ступенем комплексоутворння або гідролізу різні іони урану можна розташувати в ряд: UO2+ < U3+ < UО22+ < U4+. Відносно сильна тенденція до комплексоутворення і гідролізу іону UО22+, не дивлячись на те, що його зіряд дорівнює тільки 2, пояснюється можливо високою концентрацією позитивного заряду у атома металу. За силою комп-лексоутворення з іоном ураніла різні аніони можна розташувати в такому порядку: однозарядні – фторид > нітрат > хлорид > перхлорат; двозарядні – карбонат > оксалат > сульфат і ін.
Для урану особливо характерна координація кисневміщуючих іонів і молекул. Координаційне число урану (ІV) і з меншою достовірністю урану (ІІІ) звичайно дорівнює 8. В комплексних сполуках уран (VІ) виступає виключно у вигляді іону UО22+. Координаційне число урану (VІ) в більшості спо-лук також дорівнює 8. Зв”язок між ураном і атомами кисню в іоні уранілу переважно ковалентний. Про здатність до комплексоутворення і міцність комплексів, що утворюються, дають уявлення константи комплексоутворення (зворотня величина – константа нестійкості) U4+ і UО22+ з різними лігандами. Із таблиць видно, що хлорид-, бромід-, іодид- і особливо перхлорат-іони слабо комплек-сують з ураном, а сульфат- і фторид-іони – дуже сильно.
Константи комплексоутворення іону U4+ (25 оС)
| Реакція | К | Реакція | К | |
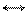 U4+ + ClO4- UClO43+ U4+ + ClO4- UClO43+
| 0,12 |  U4+ + SO42- USO42+ U4+ + SO42- USO42+
| 3,3 102 | |
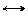 U4+ + Cl- UCl3+ U4+ + Cl- UCl3+
| 1,2 |  U4+ + 2HSO4- USO42+ +
+ 2H+ U4+ + 2HSO4- USO42+ +
+ 2H+
| 7,4 103 | |
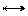 U4+ + 2Cl- UCl22+ U4+ + 2Cl- UCl22+
| 1,14 |  U4+ + F- UF3+ U4+ + F- UF3+
| 106 | |
 U4+ + Br- UBr3+ U4+ + Br- UBr3+
| 1,5 |  U4+ + 2 F- UF22+ U4+ + 2 F- UF22+
| 108 | |
 U4+ + I- UI3+ U4+ + I- UI3+
| 1,5 |  U4+ + 3 F- UF3- U4+ + 3 F- UF3-
| 5 1017 |
Константи комплексоутворення ураніл-іону (25 оС)
| Реакція | К | |
| UO12+ + ClO4 | Не комплексує | |
 UO22+ + NO3- UO2NO3+ UO22+ + NO3- UO2NO3+
| 0,24 | |
 UO22+ + Cl- UO2Cl+ UO22+ + Cl- UO2Cl+
| 0,88 | |
 UO22+ + HSO4- UO2SO4 + H+ UO22+ + HSO4- UO2SO4 + H+
| 6,4 | |
 UO22+ + SO42- UO2SO4 UO22+ + SO42- UO2SO4
| ||
 UO22+ + 2SO42- UO2(SO4)22- UO22+ + 2SO42- UO2(SO4)22-
| 7,1 102 | |
 UO22+ + 3CH3COO- UO2(CH3COO)3- UO22+ + 3CH3COO- UO2(CH3COO)3-
| 2,2 106 | |
 UO22+ +F- UO2F+ UO22+ +F- UO2F+
| 3,5 104 | |
 UO22+ +3F- UO2F3- UO22+ +3F- UO2F3-
| 2,9 1010 | |
 UO22+ +4F- UO2F42- UO22+ +4F- UO2F42-
| 6,5 1011 | |
 UO22+ + 2C2O42- UO2(C2O4)22- UO22+ + 2C2O42- UO2(C2O4)22-
| 8,3 1012 | |
 UO22+ + 3CO32- UO2(CO3)34- UO22+ + 3CO32- UO2(CO3)34-
| 2 1018 |
Як видно із останньої таблиці, здатність до комплексоутворення у ураніл-іона змінюється в дуже широкому діапазоні – від повної відсутності комплексоутворення з перхлорат-іоном до утворення виключно міцного уранілтрикарбонатного комплексу з константою комплексоутворення 2 * 1018, яка свідчить про практичну незворотність цієї реакції. Порівняно простими виглядають комлексні спо-луки уранілу з аніонами кислот, наприклад фтористоводневої UO2F3-, UO2F53-, UO2F64-. Нітрат-іон дає комплексні аніони типу UO2(NO3)3- i UO2(NO3)42-. Сульфат-іон утворює комплекси, в яких ураніл-іон зв”язаний з двома або трьома іонами SO42-.
Велике значення в хімії та технології урану мають його комплексні сполуки з органічними реаген-тами. Іони лимонної, винної, яблучної, молочної, гликолевої, аскорбінової і інших кислот утворюють стійкі комплексні сполуки з ураніл-іоном. Ще більш цікаві багаточисельні комплексні, так звані хе-латні, сполуки урану з органічними розчинниками – ектрагентами різних класів. Здатність урану до комплексоутворння особливо важлива для процесів іонного обміну і ектракції органічними розчин-никами, які досить широко і ефективно застосовують в технологічних схемах уранового виробництва
КОНТРОЛЬНІ ПИТАННЯ
1. Охарактеризуйте подвійність природи урану з точки зору його положення в періодичній системі.
2. Укажіть три окислювальних реагента, які в водних розчинах можуть достатньо повно перевести уран (IV) в уран (VI).
3. Укажіть три відновлювальних реагента, які в водних розчинах можуть достатньо повно перевести уран (VІ) в уран (ІV).
4. Охарактеризуйте стійкість головних комплексних сполук ураніл-іону.
5. Які сполуки урану на основі їх властивостей найбільш ефективно використовують в технології?
|
Дата добавления: 2014-01-04; Просмотров: 878; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 1. Нейтрон вдаряє атомне ядро Урану 235 2. Атомне ядро розщеплюється з виділенням потужної енергії 3. Вивільняються нові нейтрони 4. Вивільнені нейтрони спричиняються до ланцюгової реакції розщеплення нових атомних ядер
1. Нейтрон вдаряє атомне ядро Урану 235 2. Атомне ядро розщеплюється з виділенням потужної енергії 3. Вивільняються нові нейтрони 4. Вивільнені нейтрони спричиняються до ланцюгової реакції розщеплення нових атомних ядер