
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ферментативный катализ
|
|
|
|
Основные свойства ферментов
Биологические катализаторы, которые являются продуктами жизнедеятельности живых организмов, называются ферментами. Они обуславливают способность живых организмов осуществлять самые разнообразные и необходимые для жизнедеятельности превращения веществ. Например, процессы переваривания белков, жиров и углеводов, использование клетками организма питательных веществ, освобождение химической энергии, необходимой для жизнедеятельности, поглощение кислорода тканями и так далее. Ферменты не только расщепляют вещества, но и участвуют в синтезе биоорганических соединений в организме. Ферменты обладают следующими свойствами:
1) специфической избирательностью, проявляющейся в том, что каждый фермент действует на определённый субстрат или на ограниченное их количество, или только на определённый тип химической связи в молекулах веществ. Например, фермент пепсин способствует расщеплению белков, липаза – жиров.
2) оптимальной температурой активности фермента. Повышение температуры увеличивает скорость ферментативных реакций, а так же может влиять на направление реакций и активность ферментов. Каждый фермент проявляет максимальную активность в определённом температурном интервале, называемом температурным оптимумом. Для большинства ферментов температурный оптимум составляет 36-39оС. Повышение или понижение температуры, то есть отклонение от оптимума, губительно действует на ферменты. При повышении температуры происходит денатурация белков, уничтожающая активность ферментов. При понижении температуры изменяется конформация белков, что также снижает активность ферментов.
|
|
|
На активность ферментов могут влиять различные вещества, либо увеличивающие (активаторы), либо угнетающие (ингибиторы) их активность. Ингибиторы адсорбируются на поверхности ферментов, отравляя их, поэтому их называют каталитическими ядами.
3) реакция среды. На скорость ферментативных реакций и активность ферментов влияет также pH среды. Та концентрация ионов водорода, при которой скорость ферментативной реакции максимальна, называется оптимальной. Такой концентрации соответствует оптимум pH ферментов. Для большинства ферментов оптимум pH находится в пределах от 4 до 10. Однако имеются исключения. Например, пепсин проявляет максимальную активность при pH от 1 до 2,2. Фермент аргиназа имеет оптимум pH от 10,0 до 10,2.
В гетерогенном каталитическом процессе ферменты участвуют определёнными участками своей поверхности, которые называются активными центрами. Ферменты подразделяются на простые и сложные. Простые ферменты содержат только белковую часть, а сложные, кроме белковой части, содержат небелковую часть. Небелковой частью сложного фермента могут быть витамины, нуклеотиды, гемины, ионы металлов и другие группы. Эту небелковую часть называют коферментом, белковую часть – апоферментом.
Скорость ферментативной реакции определяется как концентрацией изменяемого вещества (субстрата), так и активностью фермента. При этом фермент образует промежуточное соединение с субстратом. Это предположение было высказано В. Анри, а затем развито и обосновано Л. Михаэлисом и М. Ментен. Они исходили из следующего уравнения:
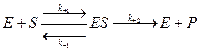
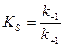
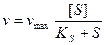
Это уравнение называется уравнением Михаэлиса-Ментен. Согласно этому уравнению, при большой концентрации субстрата 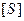
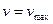 , а при малой -
, а при малой -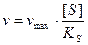 .
.
Было доказано, что уравнение Михаэлиса-Ментен применимо только к начальному периоду ферментативного процесса, так как в нём не учитывается взаимодействие с ферментом продуктов реакции. Если это учесть, то:
|
|
|
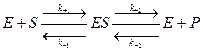
Отсюда следует уравнение Холдейна-Бриггса:
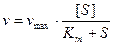 , где
, где
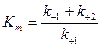 - константа Михаэлиса.
- константа Михаэлиса.
Так как 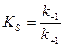 , то
, то 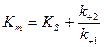
Если 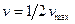 , то
, то 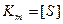 , то есть константа Михаэлиса равна той концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной.
, то есть константа Михаэлиса равна той концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 567; Нарушение авторских прав?; Мы поможем в написании вашей работы!