
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №9: Химическая кинетика и химическое равновесие
|
|
|
|
Расчет энергетических величин и выражения первого закона термодинамики для предельных процессов идеального газа
Определение термодинамической вероятности осуществления процесса
III закон термодинамики. Теорема Нернста. Постулат Планка
Важное значение в раскрытии этого закона принадлежит работам Нернста и Ричардса. В частности, Нернст в 1906г. в своей классической работе «О вычислении химического равновесия из термических данных» высказал гипотезу, суть которой эквивалентна следующему утверждению:
при Т®0 S=0 и dS=0. Важнейшим следствием этой гипотезы является то, что энтропия правильно сформированного (бездефектного) идеального кристалла при 0К равна 0. Этот постулат впервые сформулировал Планк в 1912г. По сути, это и есть формулировка третьего начала (закона) термодинамики: limT®0S=0; ST=òс(T)dT/T.
На основе этого закона разработаны современные методы вычислений изменения стандартной энергии Гиббса, а также констант равновесия при различных температурах.
Для определения термодинамической вероятности осуществления процесса используют понятие изобарно-изотермического потенциала или энергии Гиббса G=U+PV-TS=H-TS. Энергия Гиббса является функцией состояния системы и имеет размерность энергии (кДж). При постоянном давлении и температуре энергия Гиббса может служить признаком самопроизвольного процесса или наличия равновесия. Самопроизвольно происходят только процессы, ведущие к ее уменьшению, при равновесии она постоянна и минимальна по величине.
Изменение энергии Гиббса определяют как: DG=DH-D(TS), где:
DHх.р.=ånкон(DfH0298)кон-ånнач(DfH0298)нач;
DSх.р=å(nS0298)кон-å(nS0298)нач.
Если значение DG>0, то процесс термодинамически мало вероятен, причем, чем более положительно значение DG, тем менее вероятен этот процесс.
|
|
|
Если значение DG=0, то система находится в равновесии.
Если DG<0, то процесс термодинамически вероятен, причем, чем более отрицательно значение DG, тем более вероятен этот процесс.
| Наименование процессов | Характеристика | Соотношение параметров | DU | Q | W | Выражение для первого закона термодинамики |
| Изохорный | V=const | Р/T=const | nCv (T2-T1) | nCv(T2-T1) | Q=DU | |
| Изобарный | Р=const | V/T=const | nCv (T2 - T1) | nCp(T2-T1) | nR(T2-T1) | Q=DU+W |
| Изотермический | T=const | PV=const | nRTln(P1/P2) nRTln(V2/V1) | nRTln(P1/P2) nRTln(V2/V1) | Q=W | |
| Адиабатический | Q = 0 | PgV=const TVg-1=const TgP1-g =const | nCv(T2-T1) -[(1/g-1)´ ´(P2V2-P2 V2)] | -nCv(T2-T1) -[(1/g-1)´ ´(P2V2-P2V2)] | W=-DU |
Химическая кинетика – это раздел химии, изучающий скорости химических реакций. Химические реакции могут протекать с различными скоростями (от малых долей секунды до десятилетий и более продолжительных временных интервалов). При рассмотрении вопроса о скорости реакций необходимо различать гомогенные и гетерогенные реакции. Гомогенные системы состоят из одной фазы (например, любая газовая смесь), а гетерогенные – из нескольких фаз (например, вода со льдом). Фазой является часть системы, отделённая от других её частей поверхностью раздела, при переходе через которую происходит скачкообразное изменение свойств.
Скорость гомогенной реакции – это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы. Скоростью гетерогенной реакции является количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы (или массы, объёма твердой фазы, когда затруднительно определение велечины поверхности твёрдого тела):
vгомог= ; vгетерог=
; vгетерог=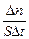 . Т.е. скорость гомогенной реакции можно определить как изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, протекающее за единицу времени.
. Т.е. скорость гомогенной реакции можно определить как изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, протекающее за единицу времени.
|
|
|
Большинство химических реакций являются обратимыми, то есть могут протекать как в прямом, так и в обратном направлениях. Рассмотрим обратимую реакцию:
aA+bB=cC+dD
Скорости прямой и обратной реакций связаны с концентрациями реагентов следующими уравнениями:
vх.р, пр=kпр[A]a×[B]b и vх.р. обр=kобр[C]c×[D]d
С течением времени скорость прямой реакции будет уменьшаться вследствие расхода реагентов А и В и понижения их концентраций. Напротив, скорость обратной реакции по мере накопления продуктов С и D будет возрастать. Поэтому через некоторый промежуток времени скорости прямой и обратной реакций сравняются друг с другом. Установится состояние системы, в котором отсутствуют потоки вещества и энергии, называемое химическим равновесием. Все обратимые процессы протекают не полностью, а лишь до состояния равновесия, в котором из условия vх.р. пр = vх.р. обр следует:
| kпр/kобр=[C]c×[D]d/ [A]a×[B]b=K |
где K - константа химического равновесия, которая зависит от температуры и природы реагентов, но не зависит от концентрации последних. Это математическое выражение закона действующих масс, который позволяет рассчитывать состав равновесной реакционной смеси.
Важнейшими факторами, влияющими на скорость реакции, являются:
1. Природа реагирующих веществ;
2. Концентрации реагирующих веществ;
3. Температурный фактор;
4. Наличие катализаторов.
В некоторых случаях скорость гетерогенных реакций зависит также от интенсивности движения жидкости или газа вблизи поверхности, на которой реализуется реакция.
1) Влияние концентрации реагирующих веществ. Представим уравнение химической реакции в общем виде: аА+bB+…=, тогда vх.р.=k[A]a[B]b – это, по сути, математическая запись закона действующих масс, открытого опытным путём К. Гульдбергом и П. Вааге в 1864-1867 гг. Согласно указанному закону, при неизменной температуре vх.р пропорциональна произведению концентраций реагирующих веществ, причём каждая концентрация входит в произведение в степени, равной коэффициенту, стоящему перед формулой данного вещества в уравнении реакции. Величина константы скорости реакции (k) зависит от природы реагирующих веществ, температуры и наличия катализаторов, но не зависит от концентрации веществ.
|
|
|
2) Зависимость vх.р. от температуры и от природы реагирующих веществ. Энергией активации Еа (в кДж/моль) называют избыточную энергию, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества. Еа различных реакций различна. Посредством этого фактора сказывается влияние природы реагирующих веществ на vх.р.. Если Еа<40 кДж/моль (т.е. мала), то скорость такой реакции велика (например, ионные реакции в растворах, протекающие практически мгновенно). Если Еа>120 кДж/моль (т.е. очень значительна), то скорость такой реакции незначительна (например, реакция синтеза аммиака N2+3H2=2NH3 – скорость этой реакции при обычных Т вследствии высоких значений Еа настолько мала, что заметить её протекание практически невозможно).
В 1889 г. знаменитый шведский химик Аррениус вывел из опытных данных уравнение, связывающее константу скорости с температурой и энергией активации. Позднее это уравнение получило теоретическое обоснование. Согласно Аррениусу, константа скорости находится в экспоненциальной зависимости от температуры: k=kmax×exp(-Ea/RT), где R - универсальная газовая постоянная, равная 8,31 Дж/моль×К; kmax - предэкспоненциальный фактор, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуре, когда все столкновения молекул реагентов становятся активными. Уравнение Аррениуса используют чаще в логарифмической форме: lnk=lnkmax-Ea/RT.
Возрастание vх.р. с ростом температуры обычно характеризуют температурным коэффициентом скорости реакции – величиной, показывающей, во сколько раз возрастает скорость рассматриваемой реакции при повышении температуры системы на 10 градусов. Температурный коэффициент (g) для разных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4 (т.е. gх.р.=2-4 раза).
Катализаторами являются вещества, не расходующиеся в реакции, но оказывающие влияние на её скорость. Явление изменения скорости реакции под действием катализаторов называется катализом, а сами эти реакции являются каталитическими. Действие катализатора обусловлено снижением активационного предела химического взаимодействия, т.е. снижением величины энергии активации. Под воздействием катализаторов реакции могут ускоряться в миллионы и более раз. Более того, некоторые реакции без катализаторов вообще не реализуются. Катализаторы широко используются в промышленности.
|
|
|
Различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор и реагенты образуют одну фазу (газ или раствор), а при гетерогенном катализе – катализатор находится в системе в виде самостоятельной фазы. Примером гомогенного катализа служит разложение перекиси водорода на воду и кислород в присутствии катализаторов Cr2O72-, WO42- и др. Примером гетерогенного катализа является окисление диоксида серы в триоксид при контактном способе получения серной кислоты из отходящих газов металлургических производств: SO2+0,5O2+H2O=(kt)=H2SO4.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 291; Нарушение авторских прав?; Мы поможем в написании вашей работы!