
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные конфигурации атомов элементов Периодической системы
|
|
|
|
Распределение электронов по различным АО называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям.
Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронографических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода электронная формула: 1 s 1.
Более полно строение электронных уровней можно описать с помощью электронографических диаграмм, где распределение по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны изображаются стрелками ↑ или ↓ в зависимости от знака спинового квантового числа. Электронографическая диаграмма атома водорода:
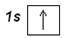
Принцип построения электронных конфигураций многоэлектронных атомов состоит в добавлении протонов и электронов к атому водорода. Распределение электронов по энергетическим уровням и подуровням подчиняются рассмотренным ранее правилам: принципу наименьшей энергии, принципу Паули и правилу Хунда.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s -элементы, p -элементы, d -элементы, f -элементы.
|
|
|
В атоме гелия Не (Z=2) второй электрон занимает 1 s -орбиталь, его электронная формула: 1 s 2. Электронографическая диаграмма:
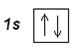
Гелием заканчивается первый самый короткий период Периодической системы элементов. Электронную конфигурацию гелия обозначают [He].
Второй период открывает литий Li (Z=3), его электронная формула: 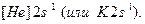 Электронографическая диаграмма:
Электронографическая диаграмма:
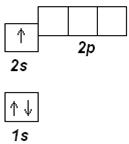
Далее приведены упрощенные электронографические диаграммы атомов элементов, орбитали одного энергетического уровня которых расположены на одной высоте. Внутренние, полностью заполненные подуровни, не показаны.
После лития следует бериллий Ве (Z=4), в котором дополнительный электрон заселяет 2 s -орбиталь. Электронная формула Ве: [He] 2 s 2

В основном состоянии следующий электрон бора В (z=5) занимает 2 р -орбиталь, В:1 s 22 s 22 p 1; его электронографическая диаграмма:
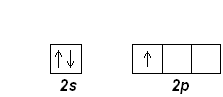
Следующие пять элементов имеют электронные конфигурации:
С (Z=6): [He] 2 s 22 p 2 N (Z=7): [He] 2 s 22 p 3

O (Z=8): [He] 2 s 22 p 4 F (Z=9): [He] 2 s 22 p 5
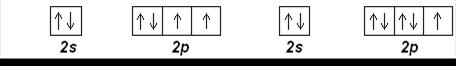
Ne (Z=10): [He] 2 s 22 p 6
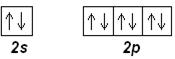
Приведенные электронные конфигурации определяются правилом Хунда.
Первый и второй энергетические уровни неона полностью заполнены. Обозначим его электронную конфигурацию [Ne] и будем использовать в дальнейшем для краткости записи электронных формул атомов элементов.
Натрий Na (Z=11) и Mg (Z=12) открывают третий период. Внешние электроны занимают 3 s -орбиталь:
Na (Z=11): [Ne] 3 s 1
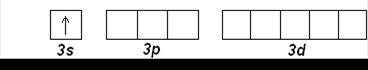
Mg (Z=12): [Ne] 3 s 2
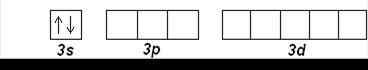
Затем, начиная с алюминия (Z=13), заполняется 3 р -подуровень. Третий период заканчивается аргоном Ar (Z=18):
Al (Z=13): [Ne] 3 s 23 p 1
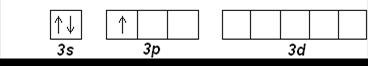

Ar (Z=18): [Ne] 3 s 23 p 6

Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3 d -орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния.
|
|
|
В четвертом периоде, в соответствии с правилом (n + l), у калия К (Z=19) и кальция Са (Z=20) электроны занимают 4 s -подуровень, а не 3 d. Начиная со скандия Sc (Z=21) и кончая цинком Zn (Z=30), происходит заполнение3 d -подуровня:
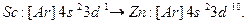
Электронные формулы d -элементов можно представить в ионном виде: подуровни перечисляются в порядке возрастания главного квантового числа, а при постоянном n – в порядке увеличения орбитального квантового числа. Например, для Zn такая запись будет выглядеть так: 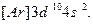 Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
В ряду 3 d -элементов у хрома Сr (Z=24) наблюдается отклонение от правила (n + l). В соответствии с этим правилом конфигурация Сr должна выглядеть так: 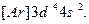 Установлено, что его реальная конфигурация -
Установлено, что его реальная конфигурация - 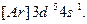 Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Отклонения от правила (n + l) наблюдаются и у других элементов (табл. 6). Это связано с тем, что с увеличение главного квантового числа различия между энергиями подуровней уменьшаются.
Далее происходит заполнение 4 p -подуровня (Ga - Kr). В четвертом периоде содержится всего 18 элементов. Аналогично происходит заполнение 5 s -, 4 d - и 5 p - подуровней у 18-ти элементов пятого периода. Отметим, что энергия 5 s - и 4 d -подуровней очень близки, и электрон с 5 s -подуровня может легко переходить на 4 d -подуровень. На 5 s -подуровне у Nb, Mo, Tc, Ru, Rh, Ag находится только один электрон. В основном состоянии 5 s -подуровень Pd не заполнен. Наблюдается «провал» двух электронов.
В шестом периоде после заполнения 6 s -подуровня у цезия Cs (Z=55) и бария Ba (Z=56) следующий электрон, согласно правилу (n + l), должен занять 4 f -подуровень. Однако у лантана La (Z=57) электрон поступает на 5 d -подуровень. Заполненный на половину (4 f 7) 4 f -подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z=64), следующего за европием Eu (Z=63), на 4 f -подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5 d -подуровень, нарушая правило (n + l). У тербия Tb (Z=65) очередной электрон занимает 4 f -подуровень и происходит переход электрона с 5 d -подуровня (конфигурация 4 f 96 s 2). Заполнение 4 f -подуровня заканчивается у иттербия Yb (Z=70). Следующий электрон атома лютеция Lu занимает 5 d -подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4 f -подуровнем.
|
|
|
Таблица 6
Исключения из (n + l) – правила для первых 86 элементов
| Элемент | Электронная конфигурация | |
| по правилу (n + l) | фактическая | |
| Cr (Z=24) Cu (Z=29) Nb (Z=41) Mo (Z=42) Tc (Z=43) Ru (Z=44) Rh (Z=45) Pd (Z=46) Ag (Z=47) La (Z=57) Ce (Z=58) Gd (Z=64) Ir (Z=77) Pt (Z=78) Au (Z=79) | [Ar] 4 s 23 d 4 [Ar] 4 s 23 d 9 [Kr] 5 s 24 d 3 [Kr] 5 s 24 d 4 [Kr] 5 s 24 d 5 [Kr] 5 s 24 d 6 [Kr] 5 s 24 d 7 [Kr] 5 s 24 d 8 [Kr] 5 s 24 d 9 [Xe] 6 s 24 f 15 d 0 [Xe] 6 s 24 f 25 d 0 [Xe] 6 s 24 f 85 d 0 [Xe] 6 s 24 f 145 d 7 [Xe] 6 s 24 f 145 d 8 [Xe]6 s 24 f 145 d 9 | 4 s 13 d 5 4 s 13 d 10 5 s 14 d 4 5 s 14 d 5 5 s 14 d 6 5 s 14 d 7 5 s 14 d 8 5 s 04 d 10 5 s 14 d 10 6 s 24 f 05 d 1 6 s 24 f 15 d 1 6 s 24 f 75 d 1 6 s 04 f 145 d 9 6 s 14 f 145 d 9 6 s 14 f 145 d 10 |
В настоящее время в Периодической системе элементов Д.И. Менделеева под скандием Sc и иттрием Y располагаются иногда лютеций (а не лантан) как первый d -элемент, а все 14 элементов перед ним, включая лантан, вынося в особую группу лантаноидов за пределы Периодической системы элементов.
Химические свойства элементов определяются, главным образом, структурой внешних электронных уровней. Изменение числа электронов на третьем снаружи 4 f -подуровне слабо отражается на химических свойствах элементов. Поэтому все 4 f -элементы схожи по своим свойствам. Затем в шестом периоде происходит заполнение 5 d -подуровня (Hf – Hg) и 6 p -подуровня (Tl – Rn).
В седьмом периоде 7 s -подуровень заполняется у франция Fr (Z=87) и радия Ra (Z=88). У актиния наблюдается отклонение от правила (n + l), и очередной электрон заселяет 6 d -подуровень, а не 5 f. Далее следует группа элементов (Th – No) с заполняющимся 5 f -подуровнем, которые образуют семейство актиноидов. Отметим, что 6 d - и 5 f - подуровни имеют столь близкие энергии, что электронная конфигурация атомов актиноидов часто не подчиняется правилу (n + l). Но в данном случае значение точной конфигурации 5 f т 5 d m не столь важно, поскольку она довольно слабо влияет на химические свойства элемента.
|
|
|
У лоуренсия Lr (Z=103) новый электрон поступает на 6 d -подуровень. Этот элемент иногда помещают в Периодической системе под лютецием. Седьмой период не завершен. Элементы 104 – 109 неустойчивы и их свойства малоизвестны. Таким образом, с ростом заряда ядра периодически повторяются сходные электронные структуры внешних уровней. В связи с этим следует ожидать и периодического изменения различных свойств элементов.
Отметим, что описанные электронные конфигурации относятся к изолированным атомам в газовой фазе. Конфигурация атома элемента может быть совершенно иной, если атом находится в твердом теле или растворе.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1215; Нарушение авторских прав?; Мы поможем в написании вашей работы!