
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в системе кристалл-раствор
|
|
|
|
Все твердые вещества, рассматриваемые нами в этом разделе, обладают способностью растворяться в различных жидкостях (растворителях). Растворение твердых веществ в растворителях всегда сопровождается тепловым эффектом: чаще всего поглощением тепла, реже- выделением. Величина и знак теплового эффекта зависят от природы твердого вещества и растворителя, температуры и концентрации раствора. Это тепло называется теплотой растворения. При кристаллизации вещества из раствора так же выделяется или поглощается тепло. Тепловой эффект при этом противоположен по знаку тепловому эффекту при растворении. В практических расчетах величину теплового эффекта при растворении принимают равной величине эффекта при кристаллизации. Сведения о величине и знаке теплового эффекта при растворении приводится в справочной литературе.
Содержание растворенного вещества в растворителе характеризуется концентрацией. Концентрация раствора, при которой наступает подвижное равновесие между кристаллами и раствором, т.е. количество растворяющихся из кристалла частиц (молекул, ионов) и кристаллизирующихся частиц одинаково во времени, называется растворимостью или концентрацией насыщения.
Растворимость различных веществ определяются опытным путем и приводится в справочной литературе. Растворимость различных веществ сильно может отличаться как по величине (кг растворяемого вещества / кг растворителя), так и по зависимости от температуры. Для веществ обладающих "положительной" растворимостью растворимость увеличивается с повышением температуры, а для веществ с "отрицательной" - падает с увеличением температуры.
На рис. (.1) представлена зависимость растворимости некоторых веществ в воде от температуры
|
|
|

Рис.1. Кривые растворимости в воде (KNO3; NaCl; KCl; Na2SO4; Na2SO4*10H2O)
Растворимость веществ в различных растворителях зависит от физико-химических свойств как самих веществ, так и растворителя и от температуры. Наибольшее распространение в промышленности в качестве растворителя нашла вода для неорганических веществ, а для органических - спирты, эфиры, углеводороды, хлорпроизводные и другие органические жидкости.
Растворимость определяет условия равновесия между кристаллами и раствором. Равновесие можно представить в виде диаграмм в координатах температура состав (Рис. 2).
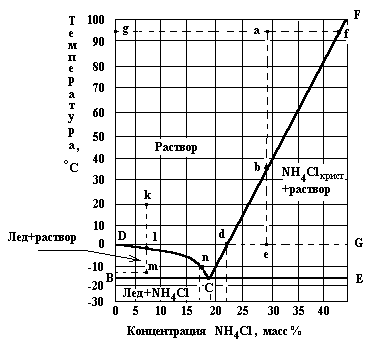
Рис..2. Диаграмма растворимости системы NH4Cl-H2O
На этой диаграмме линия СF соответствует насыщенным растворам соли (линия растворимости), СD - растворам, находящимся в равновесии со льдом (вода в кристаллическом состоянии). В точке С, называющейся криогидратной, существует три фазы: раствор, кристаллы соли и лед. Область СFЕ ограничивает область пересыщенных растворов, т.е. растворов в которых концентрация выше растворимости. При некоторых условиях, рассматриваемых ниже, концентрация растворенного вещества может быть больше его растворимости. Такие растворы называются пересыщенными. Область CFE называется полем кристаллизации соли и определяет пересыщенные растворы и механические смеси насыщенного раствора и избытка кристаллической соли.
Точки на диаграмме, расположенные выше линии DС и СF показывают состав ненасыщенных растворов.
Область ВСD называется полем кристаллизации льда, а точки в этой области характеризуют механическую смесь раствора с избытком льда.
Ниже линии ВСЕ находятся точки, отражающие состав твердой фазы, состоящей из кристаллов NH4Cl и льда (жидкая фаза отсутствует).
Диаграммы состава системы (Рис. 2) позволяют графически проводить расчеты процессов изотермического испарения растворов и кристаллизации при охлаждении.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 874; Нарушение авторских прав?; Мы поможем в написании вашей работы!