
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие. Константа хим равновесие, влияние Т, Р, С на нее
|
|
|
|
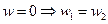 - хим. равновесие.
- хим. равновесие.
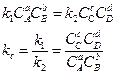
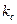 -константа равновесия хим. реакции
-константа равновесия хим. реакции
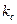 для данной температуры определяет состав равновесной смеси по которому при данных условиях можно рассчитать процесс диссоциации (обратная реакция)
для данной температуры определяет состав равновесной смеси по которому при данных условиях можно рассчитать процесс диссоциации (обратная реакция)
Характеристикой диссоциации является степень диссоциации 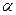 ,это отношение распавшихся молекул к общему числу молекул.
,это отношение распавшихся молекул к общему числу молекул.
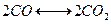
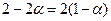 - Столько продуктов реакции останется после диссоциации
- Столько продуктов реакции останется после диссоциации
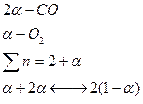 При сжигании топлива в КС ГТД диссоциация нежелательна, так как обуславливает неполное выделение теплоты. Если
При сжигании топлива в КС ГТД диссоциация нежелательна, так как обуславливает неполное выделение теплоты. Если 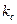 большая то =>
большая то =>  преобладает
преобладает
Влияние концентрации на 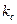
При возрастании концентрации какого либо из веществ равновесие смещается в сторону расхода этого вещества; при понижении в сторону образования этого вещества с целью возвращения в равновесие.
Влияние давления на 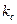

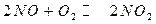
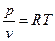 ;
;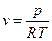 , при возрастании давления объем увеличивается в 2 раза
, при возрастании давления объем увеличивается в 2 раза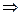 С тоже увеличивается.
С тоже увеличивается.
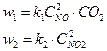 до повышения давления.
до повышения давления.
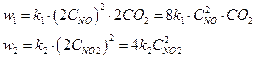 следовательно,
следовательно, 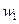 возросла в 8 раз, а
возросла в 8 раз, а 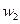 в 4 раза.
в 4 раза.
При повышении давления путем сжатия системы равновесие двигается в сторону снижения числа молекул газа в сторону понижения давления, а при понижении равновесие сдвигается в сторону возрастания числа молекул газа.
Влияние температуры на 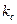
Равновесие большинства химических реакций сдвигается при изменении температур. Фактором который определяет направление смещения равновесия является знак теплового эффекта реакции. 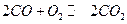
При повышении температуры равновесие смещается в направление эндотермической реакции а при понижении температуры в направлении экзотермической реакции.
Принцип Ле-Шателье: если на систему, находящуюся в устойчивом равновесии оказать воздействие, то в результате протекающих в них процессов равновесие сместится в таком направлении что оказанное воздействие уменьшится.
|
|
|
- Уравнение Аррениуса. Распределение Максвелла-Больцмана.
 Зависимость скорости реакции от температуры и природы реагирующих веществ.
Зависимость скорости реакции от температуры и природы реагирующих веществ.
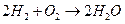 для того что бы произошла химическая реакция при соударении молекул топлива и окислителя, необходимо чтобы при столкновении произошел разрыв существующих молекулярных связей, произошла перегруппировка атомов и образовались новые вещества, если сталкивающие молекулы не обладают достаточной для этого энергией они разлетаются по закону упругого соударения.
для того что бы произошла химическая реакция при соударении молекул топлива и окислителя, необходимо чтобы при столкновении произошел разрыв существующих молекулярных связей, произошла перегруппировка атомов и образовались новые вещества, если сталкивающие молекулы не обладают достаточной для этого энергией они разлетаются по закону упругого соударения.
Для совершения реакции в этом случае сталкивающимся молекулам необходимо сообщить дополнительную энергию, вызывавшую энергию активации .
. =40…400 кДж/моль(искл нитроглицерин). Е1-внутр. энергия. Qv-эту энергию получили, тепловой эффект.
=40…400 кДж/моль(искл нитроглицерин). Е1-внутр. энергия. Qv-эту энергию получили, тепловой эффект.
Как показал Я. Вантгоф: связь 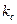 с Т.осуществляется ур-е вида
с Т.осуществляется ур-е вида
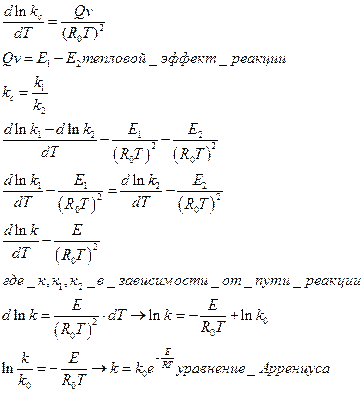 В формуле 6 сверху не минус а равно (косяк БУрыки
В формуле 6 сверху не минус а равно (косяк БУрыки
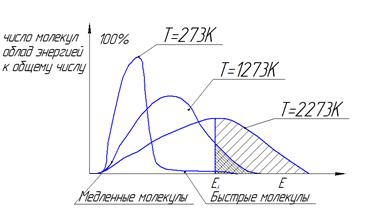
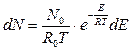 Распределение Максвела Больцмана
Распределение Максвела Больцмана
-уравнение распр Максвелла-Больцмана
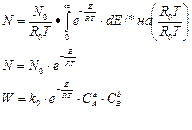
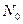 - всего молекул в системе.
- всего молекул в системе.
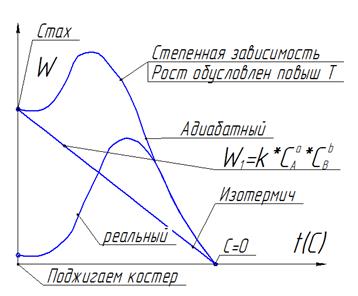
W зависит от С(линейно) и зависит от Т (степенная)
9. Цепные реакции
В ряде случаев оказывается, что теоретическая вычисленная скорость хим. реакции не совпадает со скоростью реакции, найденной экспериментально=>течение некоторых реакций не всегда можно определить с точки зрения тепловой активации молекул.
Также реакции протекающие быстрее из-за образования промежут. Активных веществ (активных центров, обладающих низкой энергией активации).
В качестве таких центров выступают свободные радикалы, отдельные ионы и атомы. Реагируя с ними исходные вещества превращаются в продукты реакции, производя при этом 1 или несколько активных частиц-такой процесс называется цепной реакцией
Пример
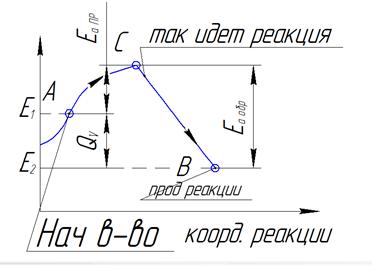
Н2 + Cl2 à 2HCl / Cl неустойчив
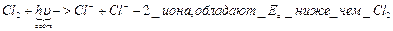
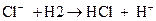
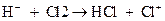
Цепные реакции протекают в 3 этапа:
1.Зарождение цепи - из молекул исх. вещества появляются молекула или атом промежуточно Активного продукта.
|
|
|
2. Разветвление цепи - в результате реакции между промеж. активным продуктом и исх. веществом происходит хим. реакция. Если в результате неё образуется 1 активный продукт, реакция называется неразветвленной. Если несколько то разветвленной цепной реакцией.
3.Обрыв цепи – молекула или атом промеж. или актив. продукта уничтожается
Пример разветл. цепной реакции:
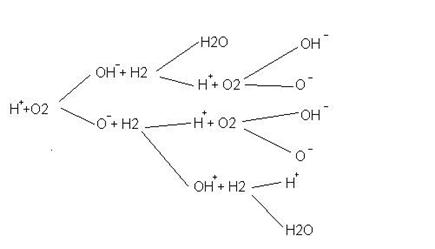
10. Катализ. Особенности горения высокомолекулярных углеводородов
Катализаторы - вещества не расходующиеся в результате реакции, но влияющие на её скорость.
Катализ - явление изменения скорости хим. реакции под действием таких веществ.
Действие катализатора объясняется тем, что в его присутствии реакция протекает через другие промежуточные стадии, которые более энергетически доступны.
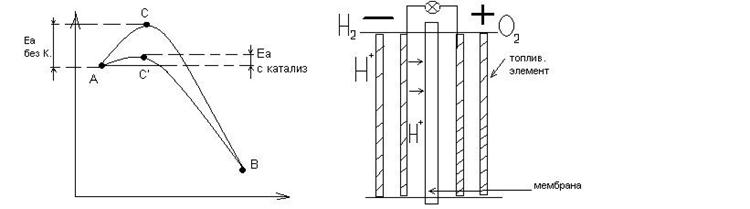
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 469; Нарушение авторских прав?; Мы поможем в написании вашей работы!